从免疫治疗到精准医学再到临床试验,我们是不是在盲人摸象?
当下的肿瘤领域,极其流行和热衷于“精准医学”,就像ge(葛)大爷在春晚上说的那样,“用了这个东东,都能长出个新脑袋来!!”
于是,我们自信了!
我们拥有“会当凌绝顶,一览众山小”的气魄;
我们充满“天生我材必有用,千金散尽还复来”的豪情;
我们踌躇“自信人生二百年,会当击水三千里”的壮志。
我们会自豪于能够根据生物标志物(BM)为新药“选择”患者。不可否认,肿瘤领域近年来的自豪当属免疫治疗,在部分肿瘤中(如黑色素瘤、肺癌)发挥了革命性的贡献。我们乐于看到这些新的治疗手段,是他们在不断改善者患者的生存和生活质量!然而,光鲜的背后,未必都是那么的妖娆。
一、谁是候选者
目前并没有很理想的生物标志物预测患者对免疫治疗的反应,也没有很好的生物标志物来预测可能出现的药物相关不良反应。部分患者可以从免疫治疗中长期获益,而部分患者却未必获益。
先以下面一张图片为例,看看免疫治疗是什么。
从图片中红圈部分可以得知,免疫治疗远非一个免疫检查点抑制剂(ICI)所可涵盖的!TA仅仅是免疫治疗的冰山一角,为此将免疫检查点抑制剂泛化为“免疫治疗”是极其不负责任的,对患者、对同道、对社会,都是一个理!
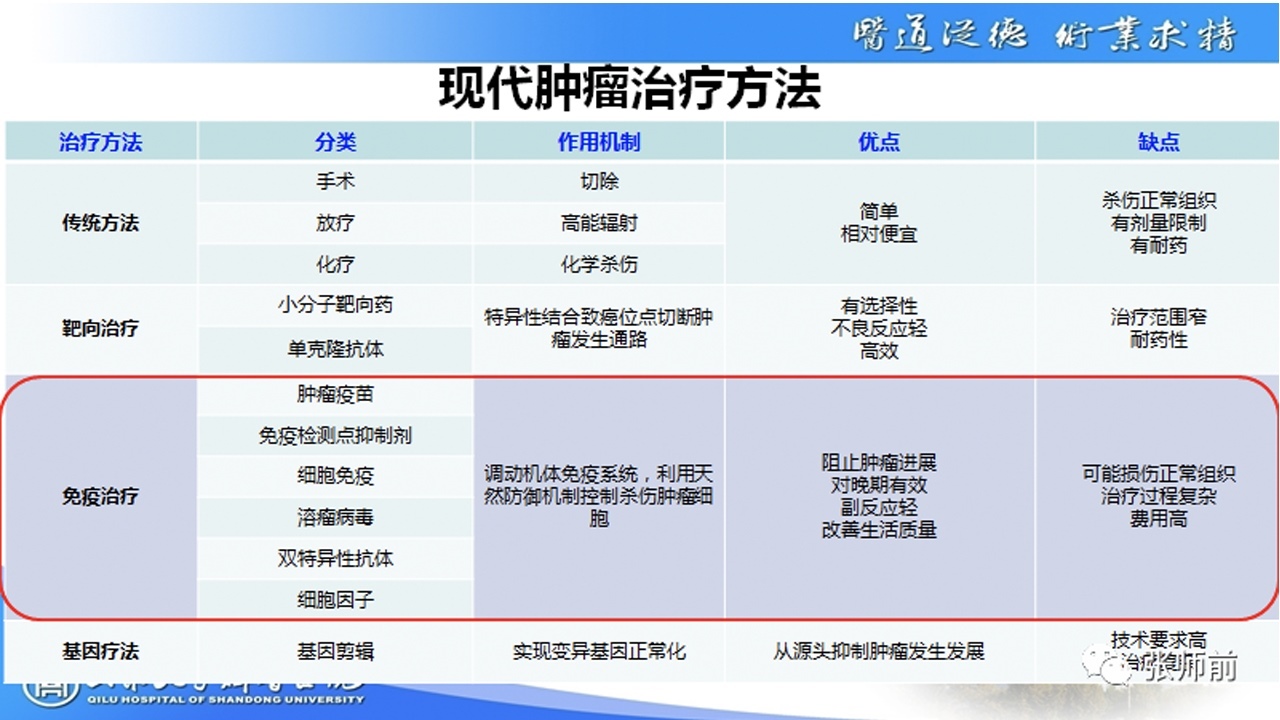
以PD-L1表达水平为例。委婉的说,目前使用的生物标志物是不完美的。PD-L1表达水平给了我们“精确”的错觉。例如,如果PD-L1>50%的患者能取得显著获益,研究通常还进行PD-L1>10%或>1%亚组分析,考虑到>50%亚组带来的显著获益,预计后两组也常显示出积极的结果。另外需要格外注意的是,在学术交流中,有的人却傻傻分不清PD-1与PD-L1各是何方神圣,将二者划等号的,预计不在少数(我也可能言过其实)。现在先捋一捋这码事!
1.表达情况不同
PD-1可表达在T细胞、B细胞等免疫细胞表面。不过在T细胞未活化时,那几乎是不表达PD-1的!仅在T细胞活化之后,PD-1才表达在T细胞表面。而PD-L1除了表达在肿瘤表面,参与免疫逃逸,还会在IFN-γ刺激下表达在抗原提呈细胞(DC细胞、巨噬细胞等)以及血管内皮细胞的表面。
2.结合受体不一样
PD-1与PD-L1互为配体与受体,事实上,两者并非一对一的“夫妻关系”。PD-1除了能与PD-L1结合,还可和PD-L2结合。PD-L2也属于B7家族,主要表达在抗原提呈细胞(DC细胞、巨噬细胞等),与PD-1结合后,能够抑制T细胞增殖及细胞因子的产生,与免疫耐受相关。
3.作用机制不一样
PD-1与PD-L1结合的单抗类药物,作用机制上,二者有区别。PD-1单抗与T细胞表面的PD-1结合,阻止PD-1与PD-L1或PD-L2结合,释放T细胞杀伤能力。而PD-L1抗体,只阻断PD-L1和PD-1的结合,而对PD-L2和PD-1的结合没有一分钱的影响。
4.对疗效的预判价值不一样
PD-L1表达水平可作为预测PD-1/PD-L1单抗疗效的标志物,肿瘤细胞PD-L1表达水平越高,意味着肿瘤通过PD-1/PD-L1信号通路发生免疫逃逸的可能性就越大。但PD-1表达水平则没有疗效预测价值。
你看看,他俩差距大得很呐!不是一星半点儿!
二、治疗时长问题
辅助治疗为大背景,大部分化疗在短期内即可完成。即使是晚期或转移性肿瘤,也不再是“生命不息,化疗不止”,例如晚期卵巢癌术后TC方案化疗6-8周期即可(当然有指征维持治疗则另当别论)。然而免疫治疗的时间可在1~3年,直至出现不可接受的AE或疾病进展,战线拉得很长很长,至于获益证据,目前还是“雾里看花”,OS数据那是凤毛麟角。
当然,以免疫检查点抑制剂为代表的免疫治疗,和化疗不可同日而语,免疫治疗可激活免疫系统,可能会在很长的一段时间内继续保持活跃。部分因不良反应而不得不终止免疫治疗的患者,可能在后续很长的一段时间内仍有免疫应答,这是免疫治疗具有长效效应的证据,实属了得,理应从机制上大书特书!
三、多大剂量算合适
研究提示,免疫治疗可能不存在剂量应答关系(量效关系,dose-responserelationship)。如0.3mg/kg的纳武利尤单抗,外周受体可能已经饱和。然而,目前实际操作中,不考虑患者体重如何,却忽视了“个性化”基于体重的剂量,致使“千人一面”,有欠“精准”。2022年ASCO年会上一项印度的头颈癌研究,节拍化疗联合低剂量的纳武利尤单抗20mg就可提高生存率!期待低剂量免疫治疗临床试验,或可发现更多的惊喜!
谈到临床试验问题,在此,仅仅说一下II期临床研究。并期待各位手动链接,了解一下有关的细枝末节,不过需要自行手动搜索哦,劳驾啦!https://mp.weixin.qq.com/s/zCBeWVpTiHcSTIBB1gj1yQ
II期临床研究又称探索性研究,是新药首次在患者中进行,以探索药物有效性为目的。所以,当把在患者中探索药物治疗有效性作为首要目的而开始临床研究时,可认为II期临床研究开始。
1.研究目标
评价药物在目标患者的初步有效性和安全性,为III期临床试验确定给药剂量和给药方案。
2.研究设计
II期的早研究常采用剂量递增设计,初步评价药物剂量效应关系;后期研究采用公认的平行剂量效应设计,确定药物对目标适应症的剂量效应关系。上述的早期研究和后期研究分别称为IIa和IIb期研究。剂量效应关系的确证研究可在II期进行,也可推迟到III期。
II期临床试验可以采用安慰剂或活性药物对照,也有采用单臂研究,比如抗肿瘤药物。
3.目标人群
几十到几百,目标适应症患者。
4.研究设计类型
有很多研究设计可用来评价量效关系,包括强制剂量滴定、供选择的剂量滴定、平行量效研究、交叉量效研究等。
四、结语和补充
总的来说,免疫治疗已经为许多患者的治疗带来了变革。不可否认的是,如何用好免疫治疗,确实存在许多的问题。正如加拿大女王大学(Queen’sUniversity)肿瘤系BishalGyawali教授所言(详见链接:https://www.medscape.com/viewarticle/979707?src=rss):“我们拥有的最有希望的精准治疗方法,目前也可能是最不精准的”。
当本文即将结束的时候,又想起一个问题,免疫检查点抑制剂耐药问题,再补充一点。从机制上说,肿瘤对PD-1单抗耐药的原因并不是真正的肿瘤耐药,而是基于机体对药物抗体自身的抗原属性产生了抗体。
1.原发性耐药
原发性耐药是肿瘤微环境中能够检测到PD-L1以及T细胞,但PD-1/PD-L1单抗用药后,完全没作用,疗效评价时肿瘤没有缩小或消失。
2.继发性耐药
继发性耐药,也称为获得性耐药。肿瘤微环境中有PD-L1及T细胞,在PD-1/PD-L1单抗治疗初期有效,但在未停药的情况下,肿瘤却重新增大或出现新的病灶。在继发性耐药中,有一特例,那就是肿瘤加速进展(HyperProgressiveDisease,HPD),主要表现为:①肿瘤生长速度超过治疗前的两倍;②肿瘤体积增大超过50%;③从治疗开始到评估发现治疗失败的时间不足2月。HPD不仅说明了“是药三分毒”,甚至堪称“毒王”,严重者可能死,需要格外警惕。
3.适应性耐药
适应性耐药是肿瘤细胞通过适应性变化,实现了免疫逃逸。可能原因包括靶点缺失、HLA表达缺失、抗原突变等。
PD-1/PD-L1单抗耐药,怎么办?
1.不换药继续用
FDA对8项黑色素瘤临床试验进行回顾性分析后发现,在PD-1/PD-L1单抗耐药后,不停药继续使用PD-1/PD-L1单抗患者,客观缓解率(ORR)为19%,中位生存期超过2年。当耐药后停药,不再使用任何治疗的患者(品一品,注意这句话),中位生存期不到1年。
2.换一种PD-1/PD-L1单抗
美国梅奥诊所的数据显示,70例帕博利珠单抗耐药的恶性黑色素瘤患者,有22例改用纳武利尤单抗或纳武利尤单抗联合伊匹利木单抗后,疾病再次缓解,疾病控制率达到45%。在PD-1单抗耐药后,换成PD-L1单抗治疗仍有可能。
3.联合化疗
分析Keynote042研究,提示PD-1/PD-L1单抗联合化疗可能有助于延缓PD-1/PD-L1单抗耐药的发生。看吧,看吧,最后还是找到“老相好的”!
- 来源|张师前



