
豫见妇瘤|宫颈癌规范化诊治专题课

赵书君 妇科·主任医师
郑州大学第三附属医院
宫颈癌是严重危害女性健康的生殖道恶性肿瘤之一,高危人乳头瘤病毒(HR-HPV)的持续感染在宫颈癌发生、发展过程中的重要作用不容忽视。由于我国地域辽阔,资源分布不均,适宜中国的宫颈癌筛查技术和策略缺乏数据支撑,HPV检测产品众多,缺乏充分的临床验证数据,细胞学、组织病理学、阴道镜医师缺乏规范化培训。中国的宫颈癌的防治工作任重道远。如何规范筛查并早期发现宫颈癌?筛查异常的结果如何解读和处理?本文中,郑州大学第三附属医院赵书君主任就宫颈癌的规范筛查及异常结果的处理进行了分享。
宫颈癌最理想的筛查策略
ASCCP宫颈癌筛查建议中提到,宫颈癌筛查的目的是发现那些有可能发展为癌症的宫颈癌前病变,使筛查益处最大化:同时避免对一过性HPV病毒感染导致的良性病变进行监测和过度治疗,使筛查潜在的风险最小化。
目前,宫颈癌常用的筛查方法为三阶梯筛查,第一阶梯(细胞学、HPV检测)、第二阶梯(阴道镜检查)、第三阶梯(组织活检、病理学检查)。
宫颈癌筛查的方法及比较
2021年11月11日,《新英格兰医学杂志》在线发表了国际癌症研究机构(IARC)对当前宫颈癌筛查方法和技术的证据评估。
HPV检测显著优于VIA,也优于单纯的细胞学检查,HPV检测与HPV+细胞学的联合筛查的有效性相当。随着疫苗接种的普及,非HPV相关性肿瘤的发病率有所上升,如胃型黏液腺癌(微偏腺癌)、神经内分泌小细胞癌、透明细胞癌、浆液性癌。
宫颈癌筛查时机
宫颈癌筛查起始年龄为21岁,除HIV感染妇女外,不论初次性生活的年龄或是否存在其他行为相关的危险因素,不建议21岁之前的女性进行宫颈癌筛查。仅0.1%宫颈癌病例发生在20岁之前,年轻女性筛查并没有降低宫颈癌的发病率。
HPV感染通常在年轻女性性交和其他性活动后获得,几乎所有感染都在1-2年内被机体免疫系统清除,而不产生瘤样改变。对于21岁以下的女性,防治宫颈癌的建议为接种HPV疫苗和保护性的性行为。
筛查方法及频率
21-29岁女性推荐单独进行宫颈细胞学检查,每3年1次;不推荐每年进行筛查,且联合筛查不推荐用于30岁以下女性。
30-65岁女性优先推荐细胞学和HPV联合筛查,每5年1次,也可每3年1次细胞学筛查,不推荐每年进行筛查。
对于此前筛查结果明确为阴性和无CIN2或更高级别病变的妇女,65岁后应停止任何方式的筛查。此前筛查结果明确为阴性的定义:最近10年内有连续三次细胞学阴性或连续二次联合检测结果阴性,且更近一次筛查在过去5年内。
既往有CIN2、CIN3或原位腺癌病史的妇女,应在病变自然消退或临床治疗后持续筛查20年,甚至延长筛查至65岁以后。
既往无CIN2或更高级别病变的全子宫切除妇女,不需再进行常规细胞学筛查和HPV检测,且没有任何理由重新开始筛查。
既往20年内有CIN2或更高级别病变,或任何时段宫颈癌病史的子宫切除妇女应该继续进行筛查。在初始治疗后20年内,每3年单用细胞学筛查。
筛查异常的处理
1.单用HPV初筛
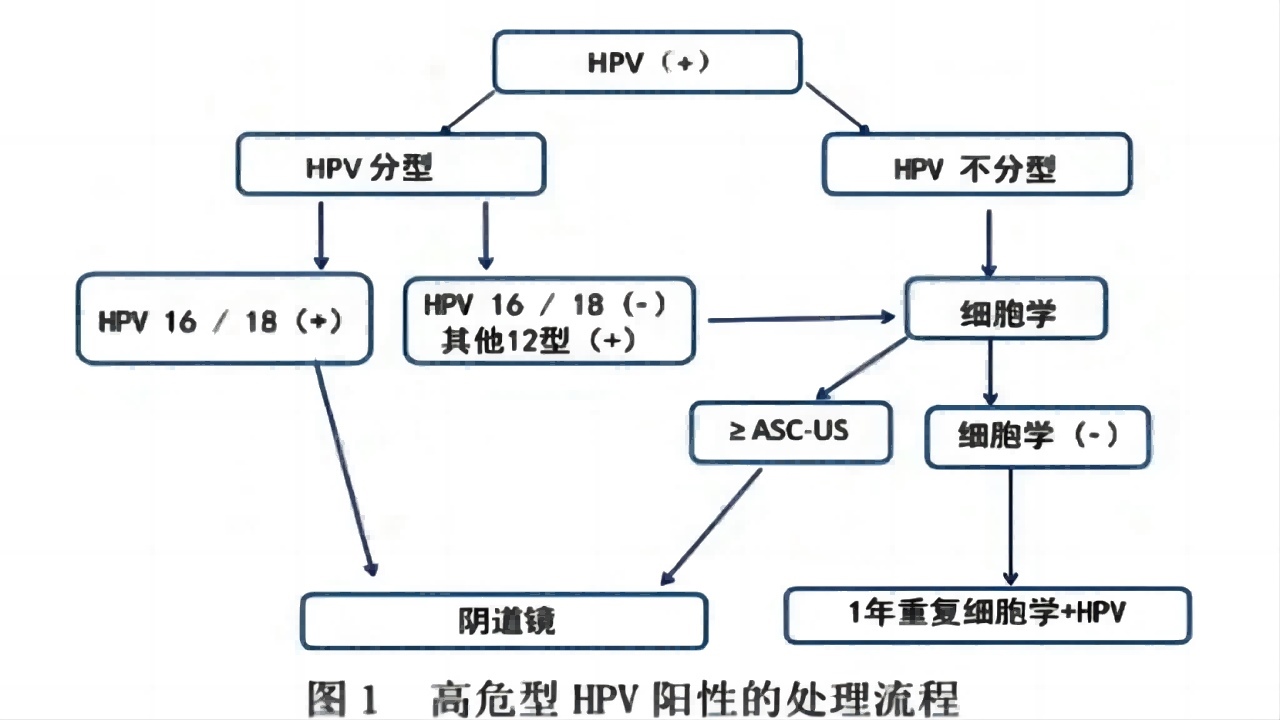
2.单用细胞学初筛

3.TCT+HPV联合筛查
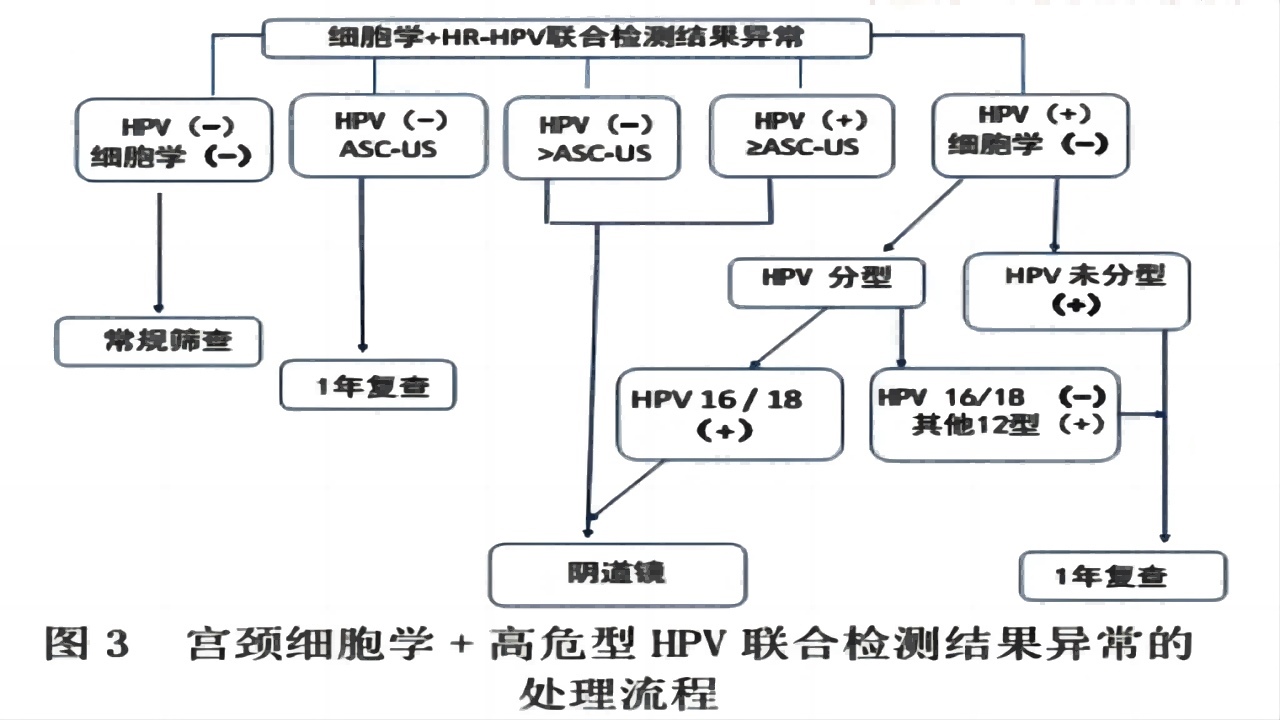
2019年ASCCP宫颈筛查异常的管理指南中给出了风险阈值评估管理思路:推荐基于风险,而非筛查结果,并且将风险值量化和细化,加入“阈值”概念,同等风险同等管理更加精细化。
临床操作阈值(ClinicalActionThresholds):疾病风险(高级别病变CIN3+)等级的下限,提示不同临床管理策略的风险水平。
<0.15%:5年内随访,一般人群HPV初筛或联合筛查阴性;
0.15%-0.54%:3年内随访,一般人群细胞学筛查阴性;
>0.55%:1年内随访,筛查轻度异常但未达到阴道镜检查;
4%-24%:转诊阴道镜,一般人群筛查为HPV+/ASCUS,LSIL;
25%-59%:快速治疗,一般人群筛查为HPV+/ASC-H;
60%-100%:首选快速治疗,一般人群筛查为HPV16/18+/HSIL。(CIN3+包括CIN3、AIS和癌症)
宫颈病变的处理
宫颈癌变分为宫颈低级别病变(LSIL)、宫颈高级别病变(HSIL)、宫颈原位腺癌(AIS)。
1.LSIL的处理原则
80%LSIL与HPV感染有关。HPV感染与子宫颈鳞状上皮内病变(squamousintraepitheliallesions,SIL)之间关系复杂。LSIL进展为HSIL或癌的风险与HPV型别高度相关,尤其是HPV16型,其他相关因素还包括年龄、免疫抑制和吸烟等。目前尚没有发现能准确预测LSIL转归的单一或联合的生物标志物。由于HPV感染的复杂性和可消退性,LSIL的诊治既容易出现漏诊,又容易过度治疗。
原则上LSIL无需治疗,应以观察为主。细胞学HSIL、ASC-H、AGC等经组织学诊断的CIN1处理应慎重,尤其是阴道镜检查不满意者,必要时需选择宫颈诊断性锥切术。
图片
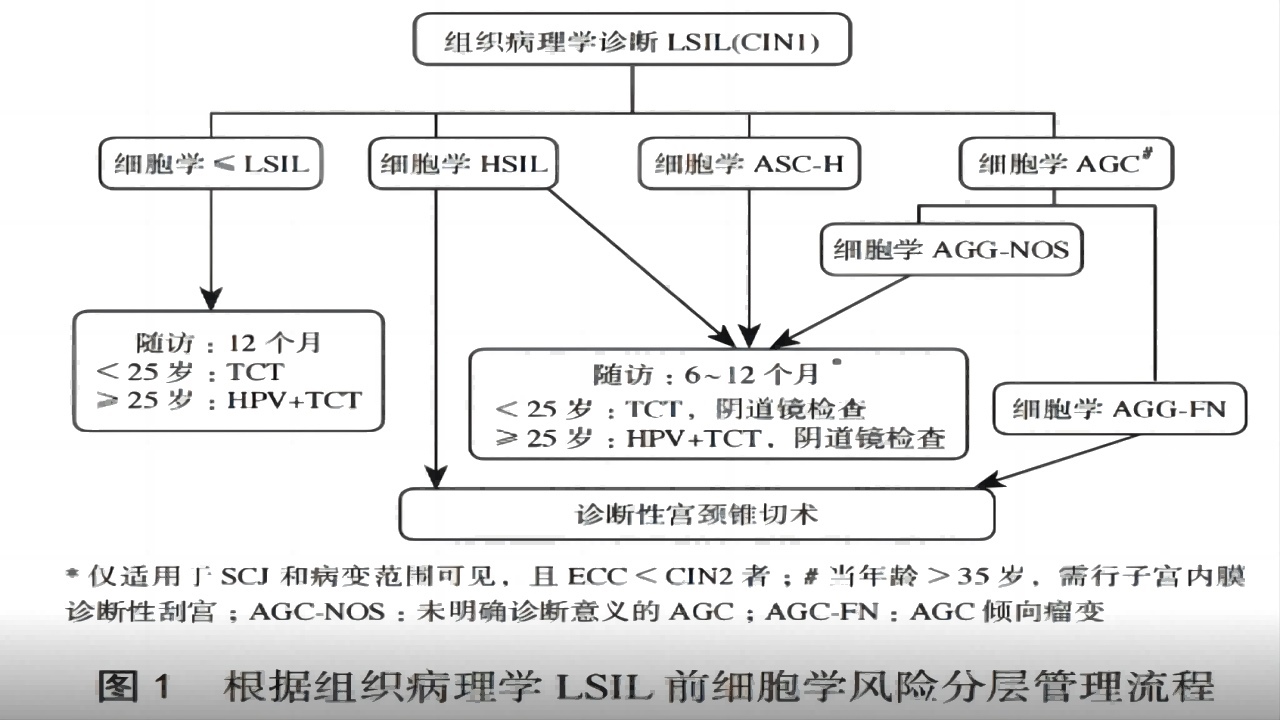
(1)年轻女性(小于25岁)的LSIL处理
小于25岁的女性感染HPV病毒多为一过性感染,无论既往细胞学结果如何,均不建议治疗。
若既往细胞学检查为ASCUS或LSIL,建议间隔12个月重复细胞学检查。对于第一次随访(第12个月)结果为ASC-H或HSIL的女性,建议行阴道镜检查。对于第24个月的结果仍是ASCUS或者更严重者,应行阴道镜检查。连续2次细胞学检查结果为阴性,可转为常规筛查。
若细胞学检查为ASC-H或HSIL者,只要阴道镜检查满意且颈管评估为阴性,建议每隔6个月采用阴道镜及细胞学检查观察,为期24个月。
(2)持续性LSIL处理
LSIL持续2年以上,需考虑持续性LSIL,继续随访或治疗均可。
其治疗方法可选择宫颈锥切术或消融治疗,消融治疗仅适合子宫颈外露部完全可见转化区(即I型转化区)。锥切方法首选LEEP。
阴道镜检查不满意的LSIL,如反复细胞学HSIL,或LEEP术后仍细胞学HSIL,不能排除子宫颈管深部有病变者,可选择宫腔镜下子宫颈锥形切除术,可减少颈管深部SIL和浸润癌的漏诊。
(3)妊娠期女性LSIL处理
对于组织学诊断为LSIL的妊娠期女性,经满意的阴道镜检查排除子宫颈浸润癌后,不建议给予任何治疗。产后6周随诊,若无LSIL,转为常规筛查,若发现异常,按相关异常进行处理。
2.HSIL的处理原则
HSIL多为HPV高危亚型持续感染所致,为宫颈癌前病变,10年内进展为宫颈浸润癌的几率为20%,30年内进展为浸润癌几率为31%~50%。常规治疗后,其癌变风险(子宫颈或阴道)降至0.7%。临床中无法从个体角度来判断某个HSIL患者何时会进展为浸润性病变,且部分患者在检出HSIL时可能已经存在隐匿性子宫颈癌,因此,对于绝大多数HSIL应给予手术治疗。
对于CIN3及任何HSIL,鳞柱交界不可见或病变上缘不可见或ECC为CIN2+建议进行锥切;对于<25岁,或者>25岁有生育要求的患者可以选择观察治疗。
(1)HSIL(CIN2P16阳性、CIN3)的处理原则
CIN2推荐治疗,除非有未来生育的顾虑,可以进行观察。但如果鳞柱交界不可见,或病变上边界不可见的CIN2不建议观察,因CIN2可能升级为跟高级别的病变。CIN3需要积极治疗,可忽略年龄或对未来生育的影响;对于特殊人群,如年龄小于25岁的女性或孕妇,应给予个体化处理。
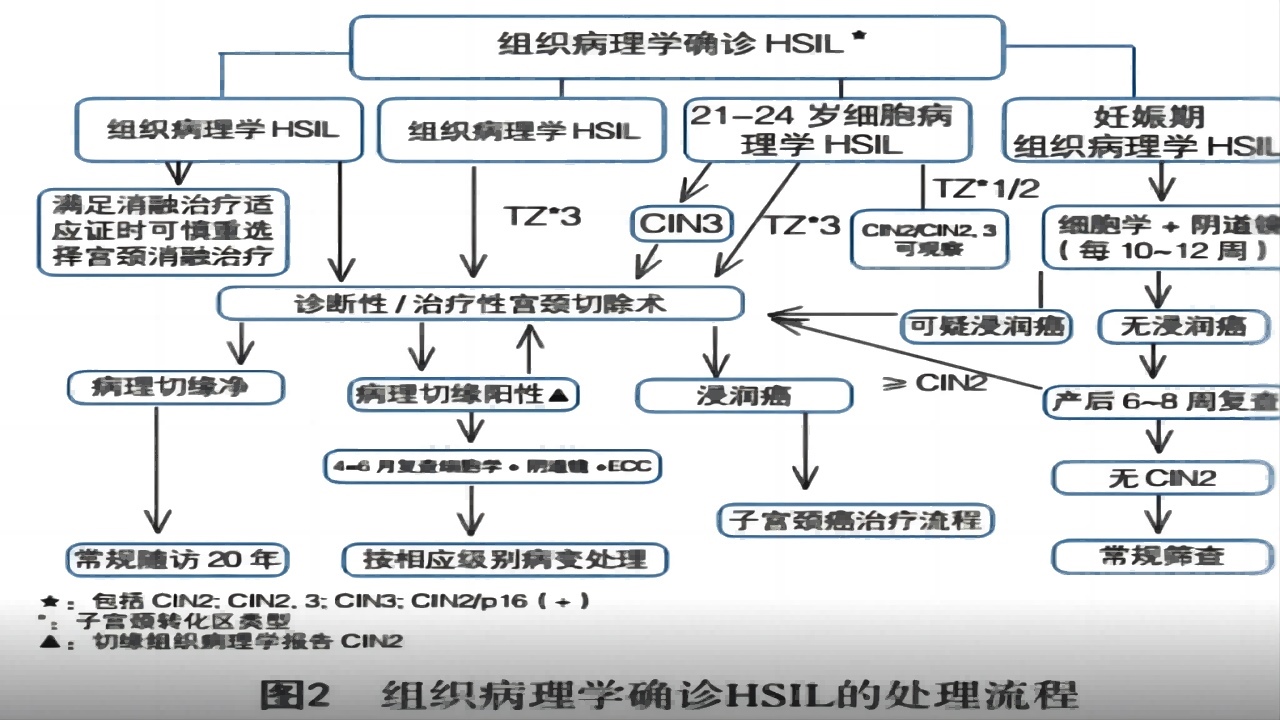
(2)年龄<25岁HSIL处理
25岁以下人群HPV感染和CIN2的自然逆转率较高,肿瘤发病率明显低于25岁以上人群。对于CIN2有生育需求的女性,观察方案适用于鳞柱交界可见,宫颈管取样无CIN2+或未定级的CIN。
小于25岁的女性,推荐采用阴道镜和细胞学检测;25岁以上的女性,推荐进行阴道镜和HPV检测,每6个月复查。在观察期间,如评估连续2次(每6个月)低于CIN2,细胞学ASC-H以下,1次/年随访基于HPV为主的检测,如果3次都是阴性,1次/3年至25年。
如CIN2持续2年,建议治疗。
3.妊娠期宫颈癌的筛查与宫颈病变的管理
(1)妊娠期宫颈癌筛查策略
ASCCP妊娠期宫颈癌筛查指南及我国孕前及孕期保健指南推荐:妊娠期行宫颈细胞学及HPV检测是安全的;既往规律进行宫颈癌筛查的女性,不必在妊娠期间进行筛查。孕期有以下临床症状,应再次行宫颈癌筛查:阴道出血、接触性出血、异常阴道分泌物;既往无规律筛查的妊娠期女性,建议在首次产前检查时进行筛查;孕期没有进行筛查的,产后42天进行筛查。
(2)妊娠期宫颈癌筛查异常的处理
妊娠期细胞学ASCUS与非妊娠期的管理相同,如需做阴道镜应推迟到产后6周进行;细胞学ASCUS,阴道镜检查及组织学结果没有CIN2+,建议产后随访。
妊娠期发现的LSIL/HSIL,如阴道镜或组织学检查未发现可疑CIN2+与宫颈癌,推荐产后6周内重新评估细胞学和阴道镜。细胞学为LSIL的21-24岁的孕妇,推荐产后6周进行阴道镜检查。
妊娠期发现的非典型腺细胞(AGC)或细胞学提示的原位腺癌(AIS),均建议阴道镜检查;妊娠期不推荐行宫颈管诊刮。
4.AIS的处理原则
宫颈原位腺癌(AIS)极少见,但近年发病率有上升趋势,是宫颈腺癌的癌前病变,其与HPV18的持续感染有关(25%-88%),50%合并有CIN2、3。无生育要求者,建议行全子宫切除术;
有保留生育愿望者,可在知情同意下行保守性的宫颈锥切术,任何锥切术式均可采用,但应保证标本完整性及切缘的病理可解释性。切除标本长度至少为10mm,无生育要求的患者,可将切除标本长度增加至18~20mm。切缘受累或手术时颈管标本存在CIN或AIS,建议再次手术。
临床上可检测到的AIS与早期子宫颈腺癌之间间隔平均13年。因此,21~24岁年轻女性AIS建议行子宫颈锥切术后进行严密随访;若切缘存在CIN或AIS病变时,建议重复性切除。术后每6个月进行1次子宫颈细胞学和高危型HPV检测,持续2年;若筛查结果未见异常,筛查间隔可延长至12个月;如果细胞学或HPV检测在随访中有异常,应转诊阴道镜并行ECC检查,如证实有复发性AIS或子宫颈高级别病变,则应行二次子宫颈锥切术,必要时行子宫切除术。
5.子宫颈癌前病变的治疗方法
(1)子宫颈消融术
子宫颈消融术(ablation)系将某些特殊能量施加于病变组织,使该处组织细胞死亡或消失,继而达到去除病变的目的。目前可选择的能量有:激光、冷冻、电灼等。子宫颈消融术可用于阴道镜检查满意、病灶较小且位于宫颈表面的CIN2、3治疗。消融治疗后无组织标本可送病理,术前应进行阴道镜下活检评估,组织学诊断排除浸润性病变。
(2)子宫颈锥切术
子宫颈锥切术是通过不同的手术器械切除子宫颈转化区,在去除病灶的同时,可以获得较为完整的组织标本,进一步明确组织病理学诊断。国内以LEEP和CKC两种术式最为普遍。
术前应结合年龄、子宫颈长度、阴道镜图像、病变分布区域及面积、转化区类型等制定拟切除子宫颈组织的范围。
Ⅰ型转化区,行完整的转化区切除(I型切除),建议切除深度7~10mm;
Ⅱ型转化区,在切除转化区的同时切除小部分的子宫颈管组织(Ⅱ型切除),切除深度为10~15mm;
Ⅰ型转化区,即Ⅲ型切除,因为转化区不能全部显示,无法确定病变组织向子宫颈管内延伸的高度,故切除子宫颈管组织的深度应达15~25mm,以减少子宫颈管切缘阳性率;
HSIL累及腺体的深度通常不超过5mm,故切除组织的厚度建议不超过7mm。
如果患者有生育要求,可以进行宫颈病灶局部切除。
授课最后,赵书君主任医师总结如下:
子宫颈癌前病变的管理应根据患者年龄、生育要求、随诊条件、医疗资源、阴道镜图像特点及治疗者的经验等综合决定,治疗应遵循个性化原则并征得患者的知情同意。临床医生应重视孕期和孕早期宫颈癌的筛查,避免宫颈癌的漏诊,孕期宫颈病变需要定期复查,直至产褥期后给予治疗。孕期不会加速宫颈病变的进展,宫颈病变不应作为选择分娩方式的影响因素。
[声明:本网站所有内容,凡未注明来源为“转载”,版权均归巢内网所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:巢内网”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们]
