
“大有镜界”-山东大学第二医院妇科内镜巡回沙龙(第十四期)

李跃 妇科·医生
山东大学第二医院
山东大学第二医院李跃医生,围绕着“宫颈原位腺癌诊治与管理”进行了详细的讲解。
一、对于疑似AIS的病例,应如何进行临床评估和诊断?
(一)第一步
1、TCT——敏感度低
腺上皮病变的病变部位较深,TCT的毛刷可能取不到病变细胞,容易出现漏诊的情况。腺上皮病变病变细胞的不典型性,依赖于细胞病理学医师的阅片水平。而细胞学更易发现共存的鳞状上皮异常,约50%~60%的AIS与鳞状上皮内病变相并存。临床还发现,任何程度的细胞异型性均可能发生AIS,比如ASCUS、LSIL。经细胞学诊断子宫颈AIS的灵敏度为50%~69%,准确性为50%,假阴性率高达3.8%~11.7%。所以,单一通过细胞学检查结果容易导致宫颈AIS的漏诊。
在TCT中,需要特别重视的提示腺上皮病变的结果:①非典型腺细胞,不能明确意义(AGC-NOS);②非典型腺细胞,倾向瘤变(AGC-FN);③子宫颈管原位腺癌(AIS);④腺癌(AC)。同时也需要重视提示高级别病变的信号,比如HSIL、ASC-H等。
2、HPV——更高的敏感度
与TCT相比,HPV有更高的敏感度。持续性HPV感染,尤其是HPV16、18型,是宫颈原位腺癌和浸润性腺癌的主要危险因素。93.9%的宫颈AIS呈HPV阳性表达,其中高危型HPV感染率为80.4%。需要注意的是,有一小部分宫颈腺上皮病变是HPV阴性的,所以注重TCT、HPV的同时,还要重视妇科查体的重要性。
鉴于78%的宫颈AIS或ECA呈HPV和TCT双阳的结果,所以推荐TCT+HPV的联合筛查,进一步提高宫颈腺上皮病变筛查的敏感性。
宫颈腺癌中检出率比较高的HPV型别为16、18、52、31、45。虽然在高级别上皮内瘤变(≥CIN2、AIS)中,HPV16感染约占46%~58%,HPV18感染只有8%,但在宫颈原位腺癌中,HPV18感染约占50%,高于HPV16(39%)。在宫颈浸润性癌中(包括鳞癌及腺癌),HPV18感染也约占50%。因此,要特别重视HPV18型阳性。在2020SGO指南中指出,当HPV18阳性时,无论阴道镜检查结果如何,宫颈管取样是可以接受的(CⅢ)。
(二)第二步——阴道镜检查
根据2019ASCCP基于风险管理共识指南,建议对异常TCT、HPV结果进行阴道镜评估,阴道镜检查应使用ASCCP阴道镜检查标准(BⅡ)。
1、AIS阴道镜检查的困难和挑战
目前并无某一种阴道镜表现是腺上皮病变的典型特征。其阴道镜图像改变不典型,常见的异常类似于不成熟化生的表现,比如柱状上皮区域的厚白上皮并不常见,所以常被漏诊。而且鳞状上皮病变的阴道镜分级标准也不适用于腺上皮病变。同时该病病变具有隐匿性,因病变主要位于宫颈管内,在阴道镜下不易暴露。阴道镜下更容易发现合并的鳞状上皮内病变。此外,由于病变不典型,阴道镜医师缺乏经验,也会导致腺上皮病变的漏诊。
2、指南建议

在2020SGO指南中有一个的表格(如上图),对不同的TCT、HPV结果、阴道镜下的表现,给出了对应的处理意见,比如多点活检、定点活检、颈管搔刮等。其中特别需要指出的是HPV18阳性的处理以及非典型腺细胞的处理。对于所有腺细胞异常+任意HPV结果,均需行阴道镜检查,同时做宫颈管内取样。如有异常子宫出血、可疑子宫内膜病变,需同时行子宫内膜取样。
3、ECC
阴道镜下活检联合ECC,比单一阴道镜活检诊断子宫颈AIS的敏感度要高,由69%提高到85%。常用的宫颈管内取样方法,包括宫颈管搔刮(ECC)和宫颈管细胞刷(ECB)。ECC是用一个小号刮匙进行颈管搔刮,有时可能会因取材不足而出现漏诊,所以在临床工作中我们要尽量想办法取得一个比较全面、有效的颈管搔刮。ECB是用一个颈管内毛刷刷取颈管内的脱落细胞,送检的细胞病理学检查。在2021年中国专家共识中提到ECB有更高的敏感度,但在国内尚没有普及。
(三)第三步
1、组织学AIS或可疑AIS的处理
阴道镜下宫颈AIS缺乏特异性改变、病变常位于宫颈管内,呈多中心或跳跃性改变,往往难以准确取材。结合阴道镜与细胞学检查,诊断宫颈AIS的敏感度仅为60%左右,约70%的患者阴道镜检查不满意。同时,宫颈AIS也常易与ECA混淆,约40%宫颈活检诊断为AIS的患者伴有浸润癌。因而,宫颈AIS的最终诊断还需依赖于诊断性锥切的结果。
2、考虑腺上皮病变行诊断性锥切术的指征:
(1)宫颈活检诊断为AIS;
(2)宫颈活检取样阴性,但细胞学为AIS或者AGC-FN;
(3)多次细胞学检查为AGC,但活检结果为阴性;
(4)ECC提示AGC但活检结果呈阴性。
即使活检诊断为AIS,仍需先行诊断性宫颈锥切术,旨在子宫切除前排除浸润性腺癌。
二、应该如何进行诊断性宫颈锥切术?
1、诊断性宫颈锥切要求
因为宫颈腺上皮病变深居宫颈管内、呈跳跃性散在分布的特点,对其宫颈锥切提出了一些特定的要求,中心原则即:要求一次切出足够深度和宽度的完整标本,保证标本切缘病理的可分析性,具体如下:
(1)锥切深度至少为10mm以上,无生育要求的患者可达18-20mm,绝经后女性因为转化区进一步内移,可达20-25mm。
(2)分层切除是不可取的,比如LEEP的牛仔帽式切除是不可取的。
(3)可采用CKC或者LEEP,切缘可评估。
(4)推荐有经验的医师进行手术。
(5)建议锥切完成后,对剩余宫颈进行颈管内取样,行ECC或ECB,进一步评估切缘情况。
(6)第一次锥切切缘阳性时,仍建议进行第二次锥切,以获得阴性切缘,进一步排除浸润性腺癌。
2、CKCvsLEEP?
既往的指南更倾向于CKC,因为LEEP对切缘的烧灼可能会影响标本的取材及切缘的病理诊断,但相关数据显示,虽然LEEP阳性切缘率高于CKC(44%vs29%),但二者所切除子宫颈锥体的体积、术后病变残留(LEEP9.1%vsCKC11%)与复发风险(LEEP7.0%vsCKC5.6%)无显著差异。而且,锥切术后患者的产科结局,如早产、胎膜早破与低出生体重儿发生率,LEEP明显低于CKC。
所以,2019ASCCP指南以及2020SGO指南均指出:允许使用任何方式进行诊断性切除,但必须保证切除标本连续完整性,并且切缘可供病理分析。
3、诊断性锥切——个体化治疗
锥切标本的大小与深度需综合患者年龄、生育意愿、阴道镜结果、宫颈大小与形状、转化区位置,制订个体化临床决策。锥切深度不足与手术切缘阳性、病变残留相关。具有生育要求者,锥切过深会影响宫颈机能。可在术前超声评估宫颈管长度,协助制定手术方案。
4、锥切术后切缘的评估
宫颈AIS锥切术的基本要求是切缘阴性,进一步排除浸润性腺癌。手术应充分评估切缘状态,并建议行子宫颈管取样。锥切术后切缘状态是关乎病变残留、复发以及进展的重要预测因素。有研究显示,当锥切内切缘与ECC均为阳性时,病变残留率高达92%,其中15%为ECA;两者结果均为阴性吋,病变残留率仅14%,ECA可能性极低。还有研究认为,切缘阴性时,AIS的复发风险仅为2.6%,切缘阳性时,复发风险达19%。
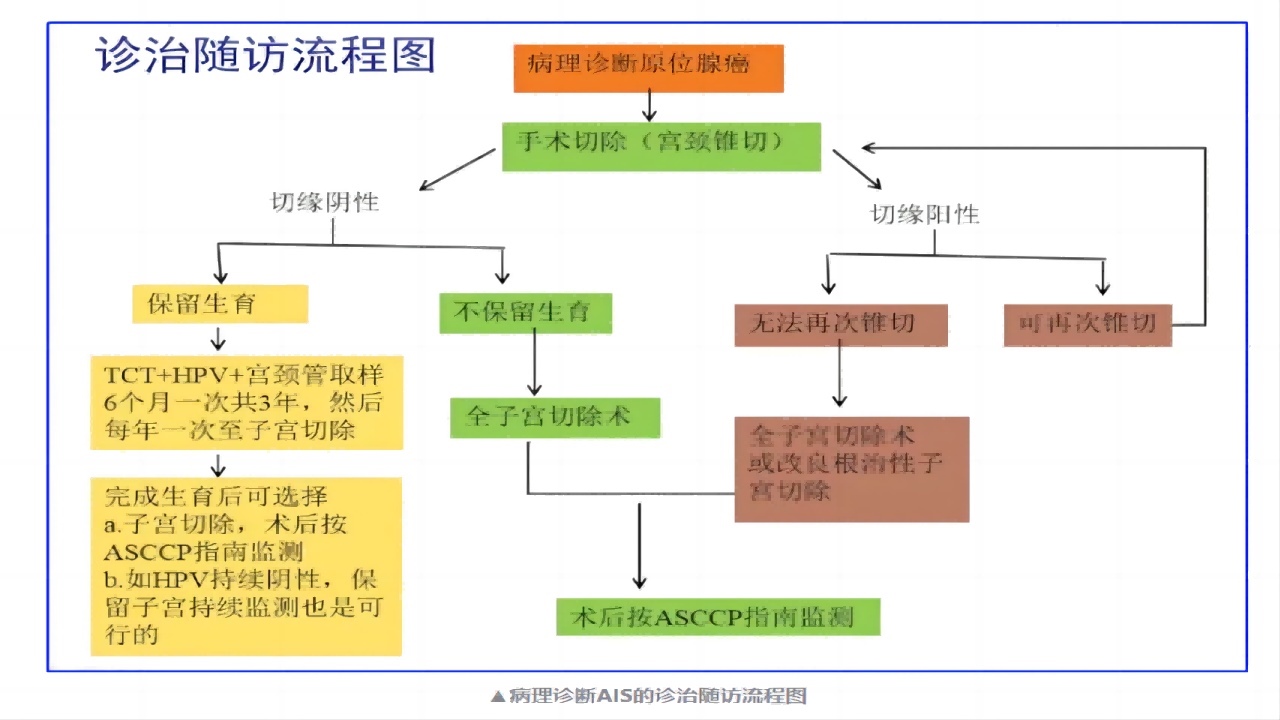
三、宫颈锥切术后病理切缘(-)与(+)的病例,下一步如何管理?


四、有生育要求的原位腺癌患者应该如何选择和管理?
AIS年轻女性保留生育力的前提就是锥切术后切缘必须是阴性的,而且患者能够很好的遵从随访监测建议。
随访期间HPV阳性是与复发相关的唯一重要预测因子。目前保守治疗后的长期随访数据有限,有结果显示,保留生育治疗后AIS的复发风险约3%,也有报道显示高达12%。因此,在患者完成生育后仍建议行子宫切除术。但如若该患者密切监测HPV呈持续阴性状态,并能接受密切随访,也可以继续随访监测。随访期间发现HPV阳性,完成生育后首选子宫切除术。
多次锥切术后切缘仍为阳性的患者,不建议保留生育力。如患者仍强烈要求保留生育力,需充分知情同意、承担相关风险,或者根治性宫颈切除术也可作为一个选择。
五、宫颈原位腺癌(AIS)治疗后推荐如何随访监测?
无论是接受宫颈锥切术或者是子宫切除术的宫颈AIS患者,均强调术后严密随访。
术后推荐根据ASCCP风险管理共识指南持续随访至少25年。同时需要重视治疗后的HPV阳性。研究认为,HPV对疾病持续、复发或进展的敏感性为90%,而TCT的敏感性为60%。此外,子宫切除术后仍需密切随访,这是因为相关研究发现宫颈不典型增生病史女性,子宫切除术后发生阴道不典型增生的风险增加。

六、总结
1.推荐对适龄女性进行TCT+HPV的联合筛查,提高宫颈腺上皮病变筛查的敏感性。
2.对宫颈AIS,推荐先行诊断性宫颈锥切术以排除浸润性腺癌,再行全子宫切除术;要求一次性完整切除,锥体深度至少为10mm,锥切的目标是达到阴性切缘;锥切术后,推荐对剩余宫颈进行宫颈管内取样。
3.子宫切除术是无生育要求宫颈AIS患者锥切术后的首选治疗方式。
4.年轻女性行AIS锥切术后保留生育力的前提是锥切术后切缘阴性,且能遵从随诊监测建议,在完成生育后仍建议行子宫切除术。
[声明:本网站所有内容,凡未注明来源为“转载”,版权均归巢内网所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:巢内网”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们]
