
泰然自若|泰安市中心医院妇科疾病大学堂

段承志 妇科·主任医师
泰安市中心医院
一、概述
子宫颈高级别上皮内病变是子宫颈癌的前驱病变,包括子宫颈高级别鳞状上皮内病变、原位腺癌。对高级别上皮内病变的规范管理是子宫颈癌二级预防的重要内容。中国优生科学协会阴道镜和宫颈病理学分会(CSCCP)专家组结合国内外最新进展和中国国情,于2022年制定了中国的共识,即《子宫颈高级别上皮内病变管理的中国专家共识》。此共识中阐述了子宫颈高级别上皮内病变的定义、转归、阴道镜评估的意义、治疗方法、管理流程、治疗后的管理、术后并发症的处理及子宫颈病变治疗后HPV疫苗接种的相关问题等,规范子宫颈高级别上皮内病变的管理,以便对临床医师起到指导作用。
二、子宫颈高级别上皮内病变的分类和演变
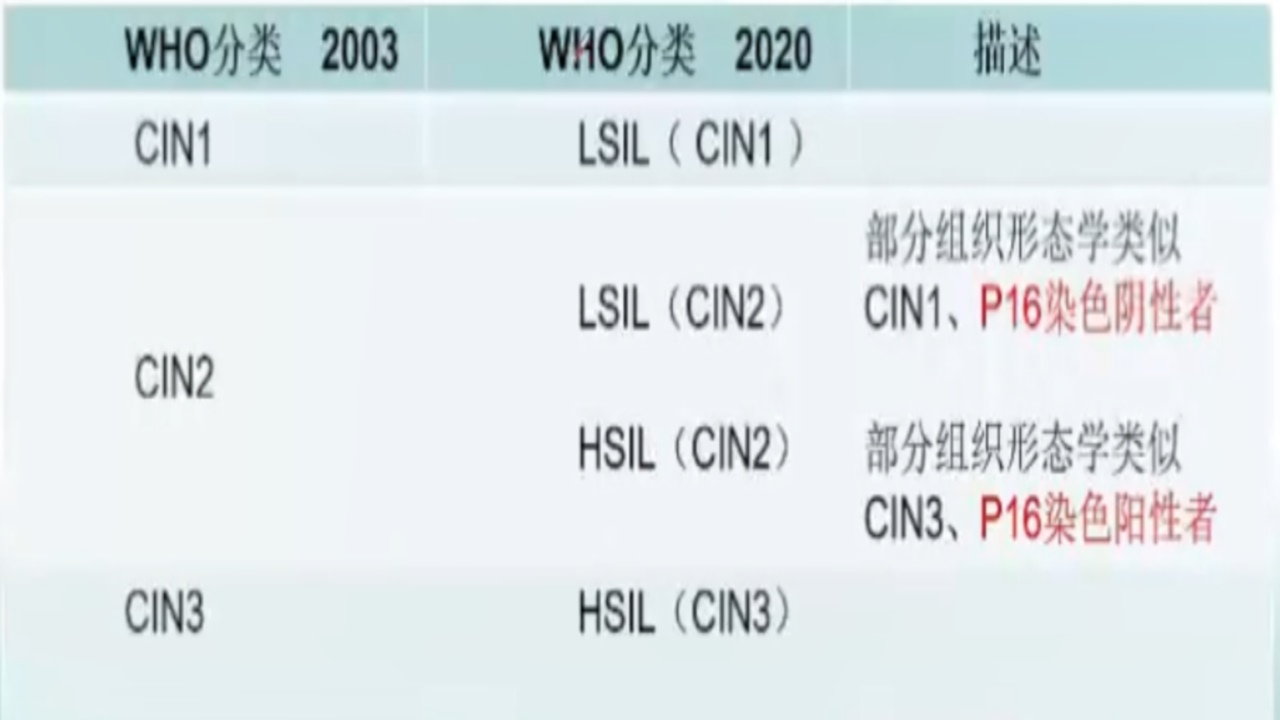
子宫颈高级别上皮内病变的分类:子宫颈高级别上皮内病变包括高级别鳞状上皮内病变(HSIL)及原位腺癌(AIS),后者也称高级别子宫颈腺上皮内病变(HG-CGIN)。
近20年来,关于子宫颈上皮内病变的分类几经演变,如图所示。
三、子宫颈高级别上皮内病变的自然转归
从高危型HPV感染到自然进展为子宫颈癌需要数十年的时间。通过子宫颈癌的筛查发现CIN,并对HSIL进行治疗,可以使子宫颈癌的发病率明显下降。CIN的自然转归有消退、持续和进展三个方向。
1.子宫颈鳞状上皮内病变
子宫颈鳞状上皮内病变CIN2的风险介于CIN1和CIN3之间,50%的患者会在两年内自然消退,32%的患者两年内病变持续存在,只有18%的患者病变会继续进展;<30岁的年轻女性CIN2则有60%的机率自然消退、23%持续存在以及11%继续进展。
CIN3具有更高进展为癌的风险,模型估计未经治疗的CIN3,平均13年有15%~23%会发展为浸润性癌,终身风险为40%。回顾性队列研究显示,未正规治疗的CIN3患者30年内有31%的进展为浸润癌;而接受常规治疗的妇女30年内子宫颈或阴道穹隆患癌的风险仅为0.7%。由此可见,对CIN3常规治疗可使子宫颈癌的发病率明显下降。
2.子宫颈原位腺癌
具体的进展率和逆转率仍不清楚。AIS发病的中位年龄为30~39岁,多数无症状,少数患者出现异常阴道出血。子宫颈腺上皮病变的早期病变同样依赖于筛查,但细胞学诊断子宫颈AIS的准确性仅约50%,故通过单一细胞学检查结果容易导致AIS的漏诊。
高危HPV检测可提高AIS的检出率,78%的AIS或浸润腺癌可表现为细胞学和HPV检测均阳性,故推荐HPV和细胞学联合检测。
从临床发现AIS到发展为早期浸润癌,通常间隔时间至少是5年。AIS锥切术后切缘阳性和阴性患者的复发率分别为19.4%和2.6%,与切缘阴性相比,浸润性腺癌常与切缘阳性相关(0.1%vs.5.2%)。
四、阴道镜评估
1.治疗前评估
(1)识别子宫颈转化区:转化区一般有4个特征,即有化生上皮、腺体开口、腺体囊肿、柱状上皮小岛。转化区判断步骤为找出新鳞柱交接→找出原始鳞柱交界→找出转化区特征→根据上述三步的特点,确定转化区范围。子宫颈转化区(TZ)是宫颈HSIL镜下观察的重点,依据新鳞柱交接部(SCJ)及其可见性分为三种类型。1型转化区(TZ1):SCJ位于子宫颈外口或子宫颈外部,完全可见;2型转化区(TZ2):SCJ有部分位于子宫颈管内,但通过暴露后全部可见;3型转化区(TZ3):SCJ位于子宫颈管内,仅部分可见或完全不可见。
(2)确认病变部位及范围:阴道镜检查首要作用是明确病变部位并指导进行活检,首要观察宫颈,对高级别病变征象进行规范的阴道镜术语描述,确定高级别病变的部位(转化区内/外边界)和病变所占的象限及面积,是否向宫颈管内延伸。此外,还要注意观察阴道壁,特别是穹隆部,以及外阴和肛周,这些部位也是HPV感染易导致病变的区域。
(3)确定子宫颈切除范围和长度:应按转化区的类型决定切除子宫颈的长度,但转化区的类型和宫颈病变的程度没有直接关系,它只是表示宫颈病变部位镜下暴露的程度。1型转化区(TZ1):需要切除7-10mm;2型转化区(TZ2):需要切除10-15mm;3型转化区(TZ3):需要切除15-25mm。临床操作时,也应参考患者子宫颈长度等进行个体化的治疗。由于病变累及腺体的深度通常不超过15mm,故切除组织的厚度建议不超过7mm。
2.治疗后的随访
宫颈HSIL治疗后推荐采用细胞学及HPV联合筛查进行随访。对于存在高级别病变残留/复发高风险的患者,如锥切标本切缘阳性(尤其是内切缘阳性)、锥切后ECC阳性、锥切后细胞学或HPV阳性者,应转诊阴道镜,尤其是高龄(>50岁)女性。此时,阴道镜检查对宫颈管和阴道壁的全面评估显得尤为重要。
五、子宫颈高级别上皮内病变的治疗方法
处理原则:所有组织病理诊断为HSIL(CIN2、CIN3)以及AIS的非妊娠患者为临床治疗对象,建议积极治疗。
治疗目的:完全去除病灶,防止癌变;进一步明确诊断,以免漏诊早期或隐匿性子宫癌。
1.子宫颈切除性治疗
是诊断和治疗子宫颈癌前期病变及早期浸润癌的重要方法。切除范围包括病变在内的子宫颈外口、鳞柱交接部及子宫颈管内组织,其优势是可以保留标本进行组织学评价,明确病变的切缘状况。根据子宫颈锥切术的目的可分为诊断性锥切和治疗性锥切。由于CIN3和AIS进展为浸润癌的风险较高,首选切除性治疗。如果病理报告为CIN2-3,应按CIN3处理。
2.子宫颈锥切术有以下方法
(1)CKC:其优点在于可提供原始状态的标本,切缘无电热灼伤,不影响病理诊断。其不足是需要住院、麻醉、手术时间较长;术后出血较多、宫颈可有狭窄、粘连和机能不全等并发症。
(2)LEEP:其优点是可在门诊实施、局部麻醉、操作简便、安全、并发症少,目前已成为应用最广泛的子宫颈锥切方法。其不足处主要为标本边缘的热损伤可能会影响组织学诊断。
(3)激光锥切术:现在国内均很少使用。
3.消融治疗
即物理治疗。对组织病理学诊断HSIL的患者进行消融治疗有严格的适应证,需慎重选择。
适应证:①转化区和病灶完全可见;②宫颈管内无组织学证实的高级别上皮内病变;③全部病变在可治疗范围内。
禁忌证:对于病灶超过子宫颈表面积的75%,向颈管延伸、腺上皮病变、既往HSIL治疗史、妊娠期及急性炎症期均不适宜行消融治疗。常见的消融治疗方法有:冷冻治疗、激光治疗和电凝治疗等。消融治疗具有操作简便、无需麻醉或仅局部麻醉、治疗后恢复快等优势。但无法获取组织学标本,不能进行病理学评估。
4.全子宫切除术
治疗HSIL时,首选子宫颈手术切除,也可选择消融治疗,但不推荐全子宫切除术作为子宫颈HSIL的常规首选治疗方法。全子宫切除术是部分子宫颈HSIL和AIS患者的最终治疗手段。
适应证:①HSIL患者非常焦虑、紧张,在知情切除子宫的风险和弊端后,仍强烈要求子宫切除者;②HSIL合并其他妇科疾病,需要切除子宫者;③无生育要求的AIS;④子宫颈锥切术后、高危型HPV持续阳性,且随访依从性差、不能定期随访的年龄较大患者;⑤锥切术后HSIL病灶残留,且重复实施子宫颈切除性手术困难。
5.其他治疗方法
现有研究数据显示,所有非手术疗法,包括局部用药、治疗性疫苗和其他生物制剂,对于组织病理学诊断HSIL的治疗效果不确切,目前仅用于科学研究领域。
六、子宫颈高级别上皮内病变的管理流程
1.HSIL的管理流程
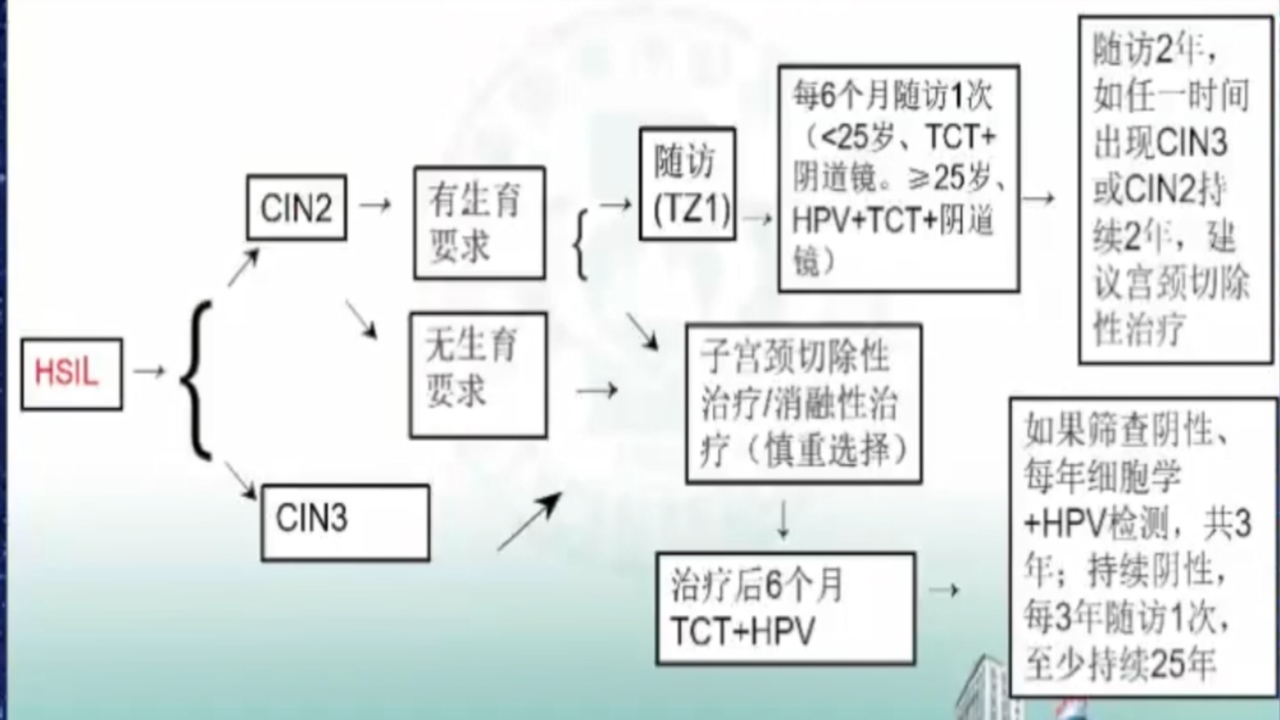
妊娠期伴HSIL者,目前认为妊娠不会促进子宫颈HSIL病情进展,子宫颈HSIL也不会影响妊娠的进程、子宫颈的成熟度和分娩进程,不会增加其产科合并症/并发症,故子宫颈HSIL不应作为产科改变分娩方式的依据。
因妊娠期HSIL进展率较低,50%以上患者产后可恢复到较低级别,故不建议在怀孕期间对HSIL(CIN2或CIN3)进行治疗。
妊娠期由于激素的作用,可能会影响对病灶的准确判断,常易过度诊断。在全面检查、宫颈活检排除子宫颈浸润癌后,应每间隔12周复查细胞学及阴道镜一次,产后6-8周阴道镜复查。
2.AIS的管理流程
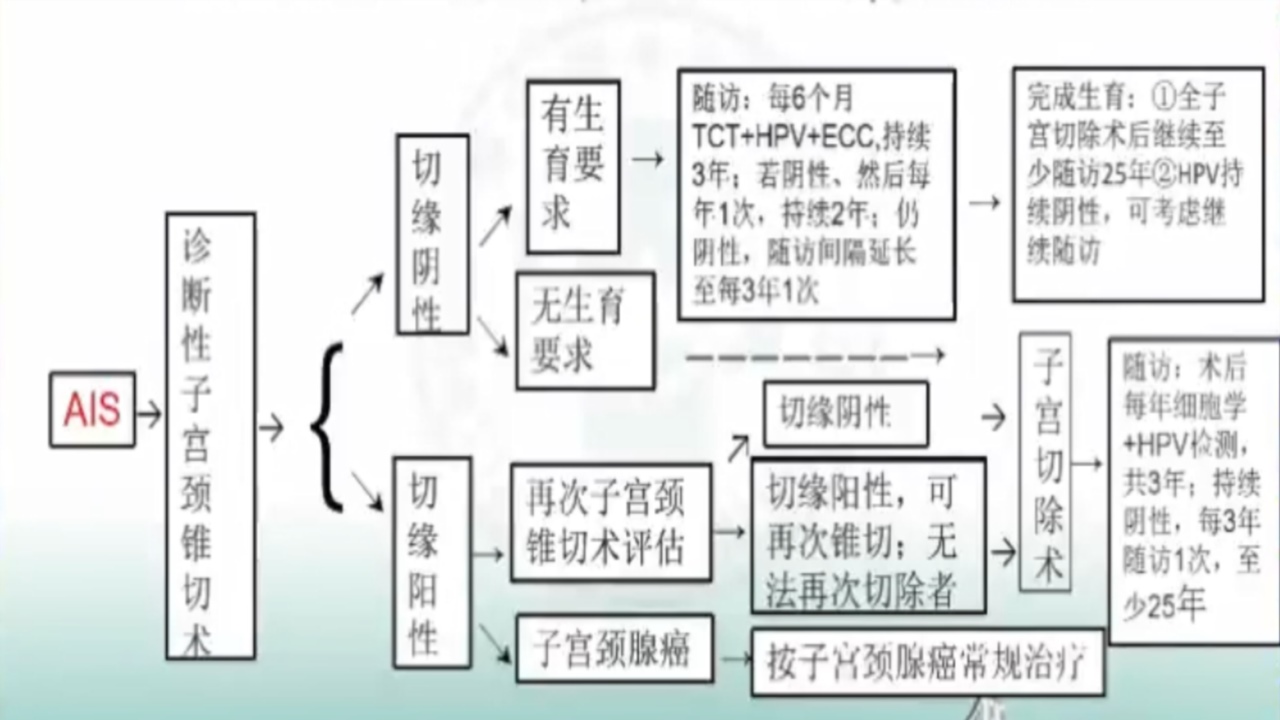
AIS起源于子宫颈腺上皮,常为多灶性,且10%~15%的患者存在“跳跃性”病变,对活检组织病理学拟诊的AIS应行子宫颈诊断性切除术。
子宫颈诊断性锥切术指征:①阴道镜下多点活检或ECC病理提示AIS;②细胞学结果为不典型腺上皮细胞倾向瘤变(AGC-FN)、AIS者,虽经阴道镜检查及活检病理结果为低级别鳞状上皮内病变(LSIL)及以下者,也建议行子宫颈诊断性锥切术,尽可能保持标本的完整性,并建议行残留子宫颈管的ECC。
无生育要求AIS者的管理:对于切缘阳性、多灶病变,或残余子宫颈管ECC阳性者,如经评估无法再次进行锥切术时,在充分告知患者风险情况下可选择全子宫切除术。
有生育要求AIS者的管理:经子宫颈诊断性切除术后且切缘阴性,有保留生育的愿意并能够严密随访者,可选择随诊;对经多次切除术后仍不能达到切缘阴性者,不建议行保留生育的管理。
七、子宫颈高级别病变治疗后的随访管理
1.病变复发或进展的风险
对子宫颈HSIL的切除性治疗,可以降低进展为浸润性癌的风险。尽管如此,切除性治疗后患者仍有病变持续/复发以及向浸润性癌进展的长期风险。HSIL(CIN3)/AIS治疗后5年HSIL+复发风险达8%~16%,患子宫颈癌风险是普通人群的2~5倍,且治疗25年后仍有患子宫颈癌的风险。
2.主要随访指标
子宫颈切除性治疗后随访时,高危型HPV检出HSIL及以上病变比细胞学检查更敏感(95%vs70%),特异性相似。同时,该指标是AIS治疗后疾病复发或进展为浸润性癌最重要的独立预测因子。因此,基于HPV(联合筛查或者单独HPV检测)的检测手段是子宫颈切除性治疗后最主要的随访手段。
3.HSIL治疗后的随访管理
HSIL治疗后,无论切除标本的切缘状态如何,均推荐在术后6个月进行HPV检测。
首次HPV检测阴性者,推荐每年进行一次HPC或联合检测,直到连续3次检测阴性,之后每间隔3年进行一次HPV检测,至少25年,即使超过65岁,如身体状况允许,也可继续每隔3年监测一次。
如果HPV监测阳性者,应进行阴道镜检查和适当的活检,也可行阴道镜检查和宫颈搔刮术(ECC)。
4.切缘阳性的随访管理
研究发现,子宫颈HSIL在子宫颈切除性治疗后,切缘阳性和阴性者病变持续存在的发生率分别约为18%和4.3%。然而,切缘阳性并非病灶持续的独立危险因素,特别是LEEP的程序化电凝可以清除边缘未切净的病灶,因此,应客观面对并了解切缘阳性与病灶残留的关系,一味试图通过无限扩大子宫颈去除范围以规避之或全部进行二次手术是不科学,也不可取的。故不支持对所有切缘阳性者进行重复性切除手术,应制定个体化治疗方案,更不应轻易判断病灶残留而切除子宫。
对初次子宫颈切除术后切缘阳性患者的治疗,需要根据患者自身具体情况(个体化)来考虑,可选择的治疗方式有:①密切随诊;②再次宫颈病变诊断性切除术;③进行全子宫切除术。
①密切随诊
a.宫颈切缘为CIN1-2级;
b.患者年龄较小,有保留子宫的意愿和(或)有生育要求,担心治疗对妊娠带来影响的患者,而且患者对CIN有一定认识,愿意接受定期随访;
c.随访观察需在6个月内进行一次HPV检测,也可行阴道镜检查和ECC。
②再次宫颈病变诊断性切除术
a.宫颈切缘为CIN3级,要求保留子宫者,或患者年轻,有生育要求者;
b.年龄>50岁且内口切缘阳性者及随访依从性差的患者,优先选择再次子宫颈切除性手术;
c.当切缘或ECC为CIN2阳性,年轻患者且不担心治疗对未来妊娠结局造成潜在影响时,可考虑重复子宫颈切除或随诊观察。
③全子宫切除术
a.绝经后妇女;
b.年龄较大,无生育要求,知情希望切除子宫者;
c.残留宫颈组织过少,因解剖因素无法实施重复子宫颈的切除,可以接受全子宫切除术;
d.合并子宫良性病变需要切除子宫者;
e.如果重复子宫颈切除术后病检仍为HSIL,则建议行子宫切除术。
5.AIS治疗后的随访管理
AIS子宫颈切除性治疗后保留生育功能的随访管理
AIS切除性标本切缘阳性者,必须再次实施切除性手术以期获得阴性切缘。对于重复切除后切缘仍阳性者,不建议进行保留生育的管理。
切除性标本切缘阴性者,推荐治疗后间隔6个月的子宫颈联合筛查和颈管取样,至少持续3年,然后每年1次、持续至少2年。对于连续5年的随访结果均为阴性者,可接受每3年1次无限期的筛查随访。
妊娠者在监测期间HPV检测和子宫颈内取样结果持续阴性,分娩后如有保留生育的愿望可以继续监测。否则,优先选择在分娩结束后行子宫切除。
八、子宫颈锥切术后并发症的处理
1.近期并发症
出血:子宫颈锥切出血的发生率为术中3.4%,早期术后0.6%,晚期术后4.9%。压迫、电凝、缝扎是锥切术中或术后止血最常用的方法。此外,应用Foley气囊导管插入子宫颈管压迫止血,安全有效。子宫动脉栓塞也是多学科合作微创止血的方法。应用氨甲环酸可减少子宫颈锥切术后迟发出血。
感染:子宫颈锥切感染发生率4.3%。处理:针对感染,目前没有足够证据支持预防性应用抗生素减少宫颈锥切术后感染并发症。因此,抗生素的使用应权衡利弊。
损伤:发生率较少。主要对症处理。
2.远期并发症
子宫颈狭窄粘连:锥切术后会形成瘢痕挛缩,导致子宫颈狭窄粘连,严重者完全封闭子宫颈。发生率为5.4%。最常发生在绝经后和产后妇女(分娩12个月内),可导致宫腔积血积脓、继发不孕及盆腔子宫内膜异位症。临床表现为月经引流不畅及下腹疼痛。子宫颈狭窄粘连不利于后续随访管理,为了不影响子宫颈管内病变的诊断时,可行子宫颈扩张术有利于随访。子宫颈扩张后再次狭窄粘连,可放置子宫颈管支架,应定期复查。
子宫颈子宫内膜异位:LEEP术后可发生子宫颈或颈管部位的子宫内膜异位,并可成为术后随访过程中子宫颈不典型腺上皮的来源从而导致不必要的误判。若宫颈子宫内膜异位症症状明显,可考虑激光气化异位灶及消融术。
对妊娠结局的影响:锥切手术破坏子宫颈完整性,缺乏机械性支撑作用,修复组织伸张性降低,同时阴道免疫微环境改变,研究发现,术后妊娠中孕期流产率明显增加,早产、低出生体质量、胎膜早破及围生期病死率的风险增加。锥切深度与早产的发生和严重程度呈正相关。子宫颈锥切术后6月子宫颈再生长度与锥切切除深度成负相关。为了减少子宫颈再生、减少子宫颈损伤和将来的产科并发症,应注意控制锥切范围。
锥切术后妊娠应加强监护,超声监测子宫颈管长度。妊娠中期发生子宫颈机能不全应及时保胎,必要时行子宫颈环扎术。子宫颈环扎虽然增加额外的手术风险,但其仍是一项安全有效的选择。目前并无证据显示,子宫颈锥切是剖宫产的指征。
九、HPV疫苗接种相关问题
虽然宫颈HSIL(CIN2,CIN3)目前已有较为确定的治疗方法,但治疗后病变持续/复发性的风险仍明显高于普通人群。从目前对HPV疫苗研究的事后分析和真实世界应用后随访资料看,子宫颈HSIL(CIN2,CIN3)治疗后女性接种预防性HPV疫苗,可显著降低治疗后病变的持续/复发率,而且无论基线HPV血清学和HPVDNA状态如何。
因此,推荐适龄、无禁忌证、因宫颈HSIL(CIN2,CIN3)治疗的女性接种预防性HPV疫苗,以降低其复发的风险。
目前接种预防性HPV疫苗预防治疗后复发的机制还未完全清楚,既往对治疗后女性的研究也多为临床试验数据回顾性分析、非随机试验研究、未根据基线HPV状态或病变情况随机接种疫苗、未排除病变残留等,因此,仍需要设计严谨的大样本前瞻性随机对照试验进一步证实。
十、小结
综上所述,临床医师在处理HSIL时,应在充分理解下生殖道解剖组织学、HPV及其相关疾病的发展史,在充分解读阴道镜图像的基础上,需结合患者年龄、生育需求、子宫颈转化区类型、阴道镜图像、既往妇科手术史及随访的可行性等多方面因素,综合制定治疗方案,确定手术范围。以达到精准治疗、去除病灶,同时最大限度保留患者的正常子宫颈组织以维持其功能,造福患者。
[声明:本网站所有内容,凡未注明来源为“转载”,版权均归巢内网所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:巢内网”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们]

