
大爱无疆|妇科肿瘤诊治新进展及康复管理系列讲座

陈亮 妇科肿瘤·教授
山东省肿瘤医院
一、血液学不良事件及处理
血液学不良反应是PARPi最常见的不良反应。骨髓抑制的主要发生机制为抑制骨髓细胞的生长。细胞实验表明,PARPi发挥抗肿瘤作用的浓度与抑制骨髓细胞的浓度接近。贫血常见于奥拉帕利、尼拉帕利,血小板减少常见于尼拉帕利。
1.贫血
机制:靶向PARP2抑制,PARP2的抑制会损害红系祖细胞的分化并降低小鼠红细胞的预期寿命,导致贫血发生;因此使用Epo促红细胞生成效果不佳,最有效且直接的解决办法是输血。
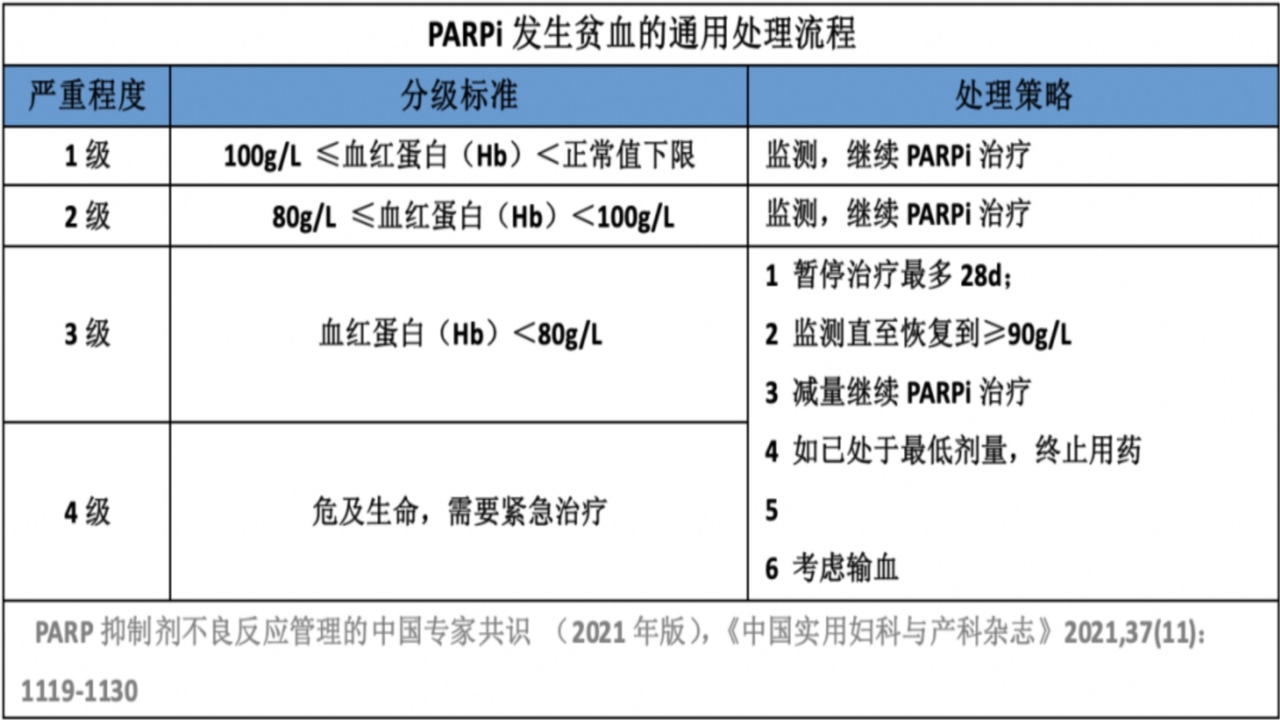
2.血小板减少

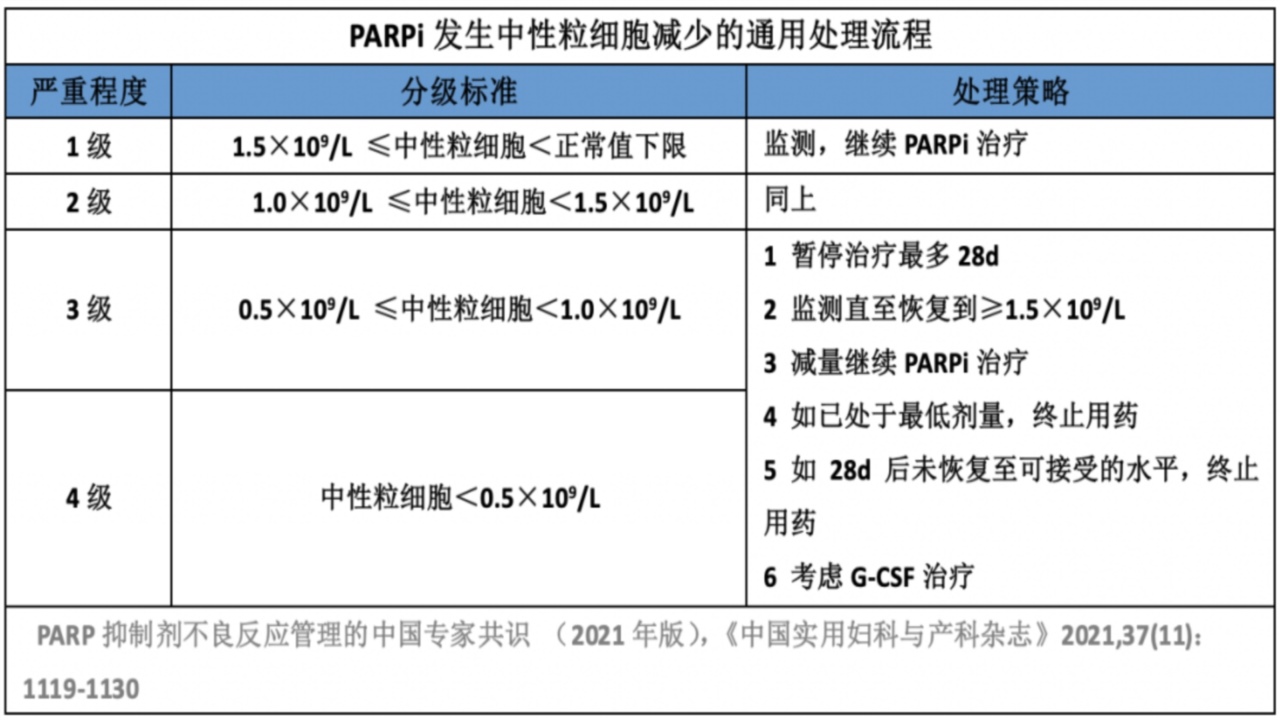
3.中性粒细胞减少
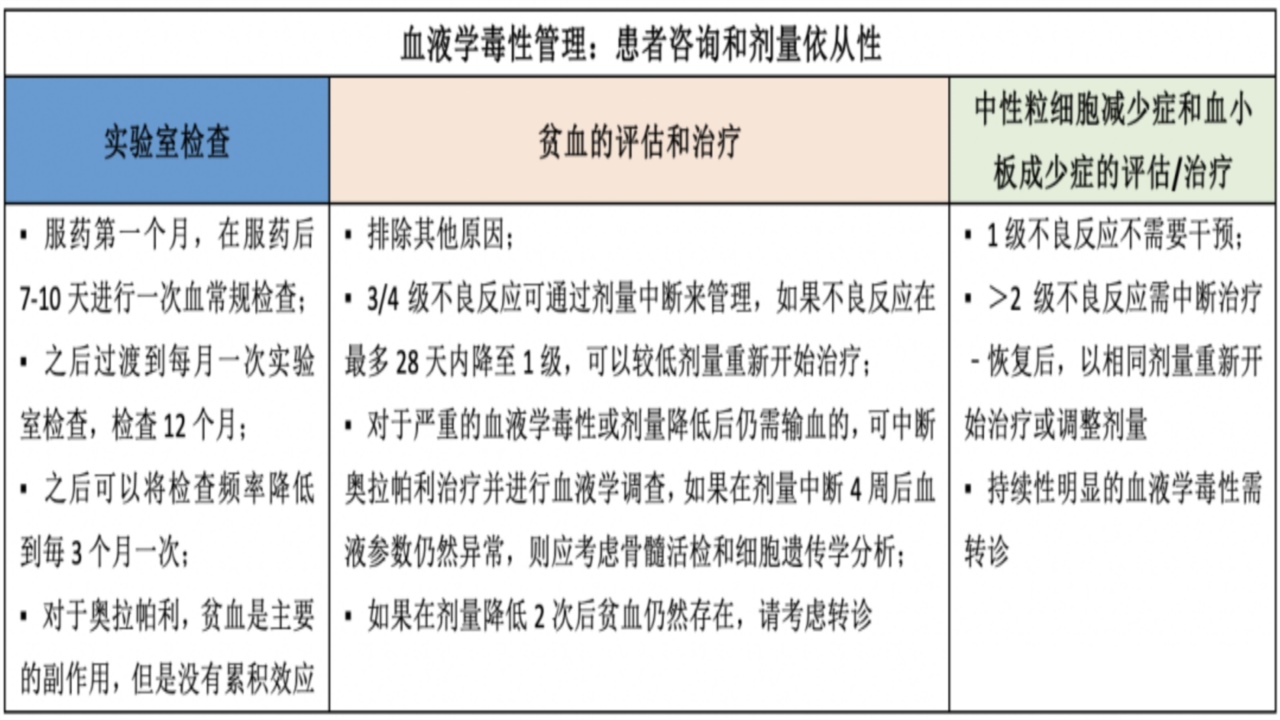
4.血液学毒性管理
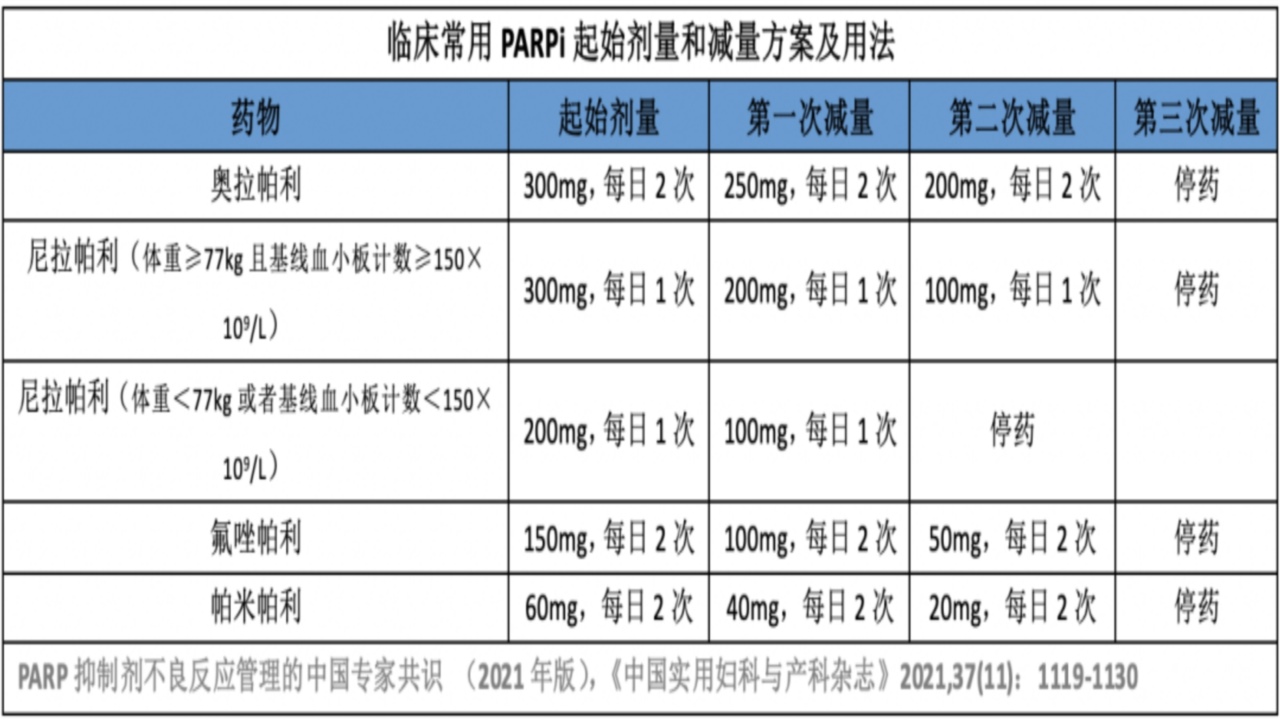
二、常见非血液学不良事件及处理
常见的非血液学不良反应主要有消化道反应(恶心、呕吐、便秘、消化不良)、肾毒性(血清肌酐升高、低镁血症等)、疲乏、以及实验室检查异常(胆固醇升高、转氨酶升高)等。
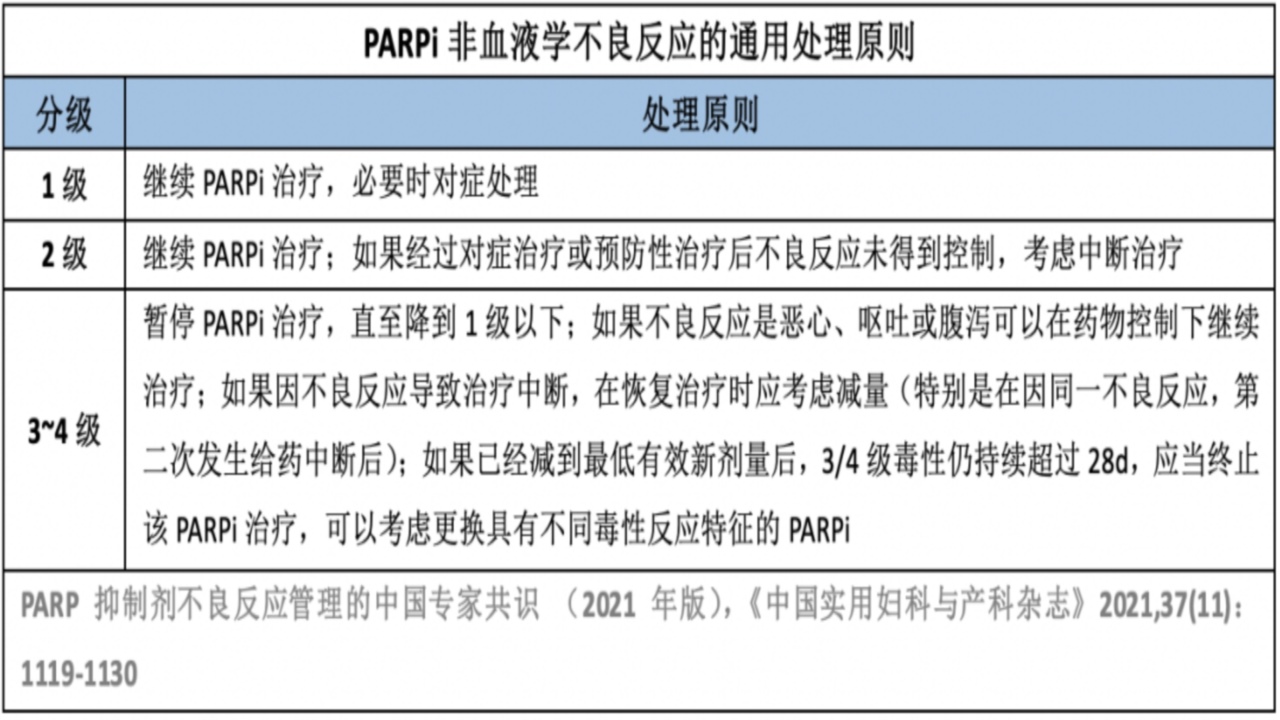
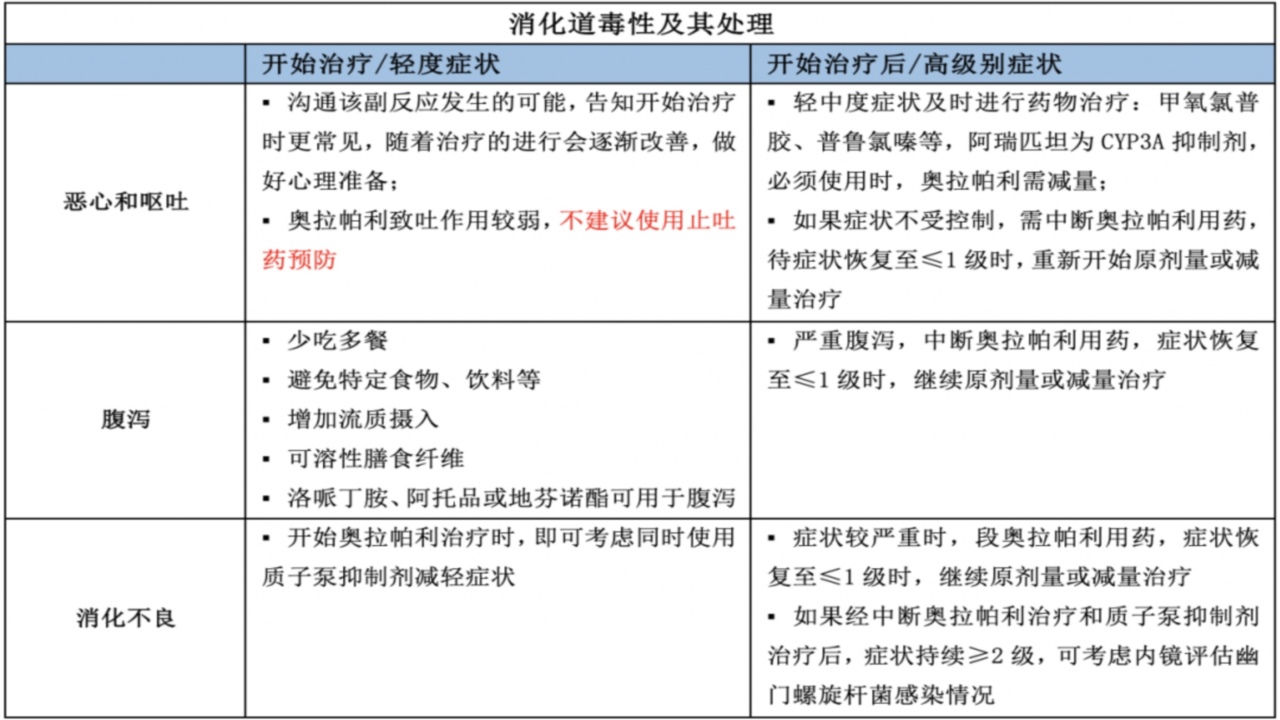
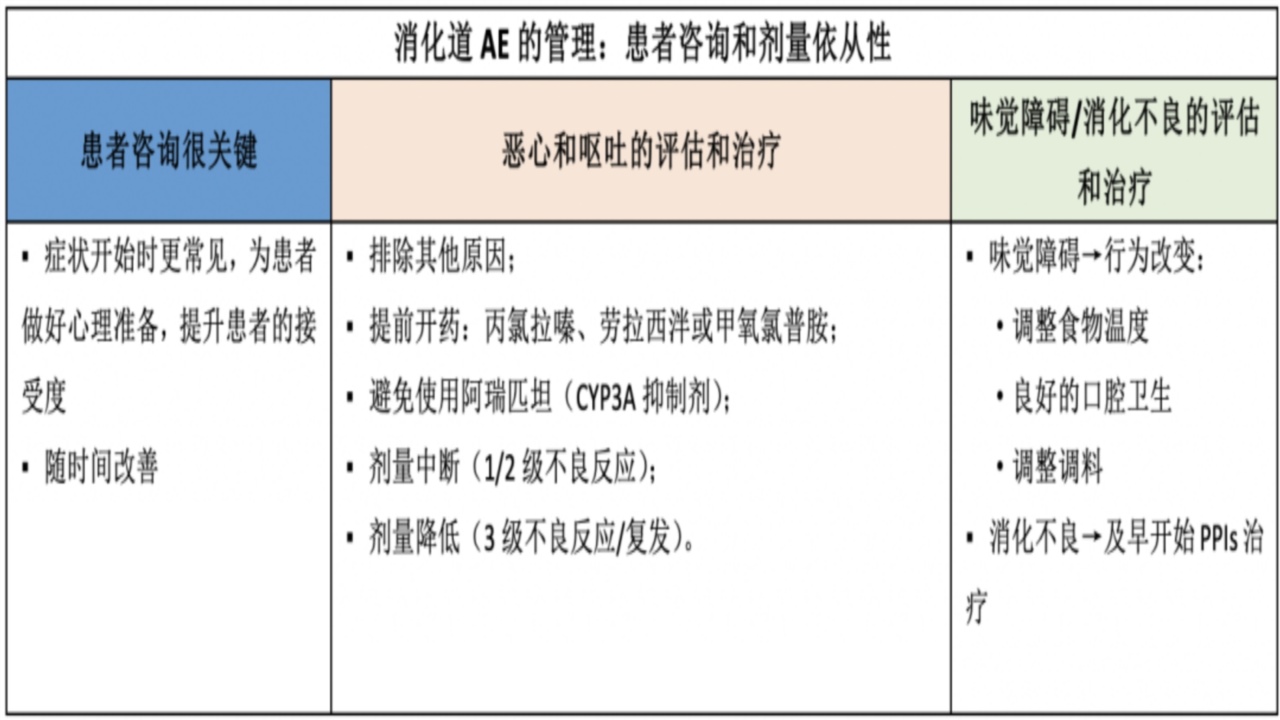
1.消化道毒性
PARPi导致胃肠道反应作用机制:胚系突变存在于每个细胞;PARPi作用于肿瘤细胞的同时,也对正常细胞的DNA修复造成抑制;PARPi的协同致死机制,导致DNA修复破坏,结局与铂类药物作用相似;可能是PARPi与铂类有相似的不良反应的原因,包括恶性、呕吐、疲乏等。
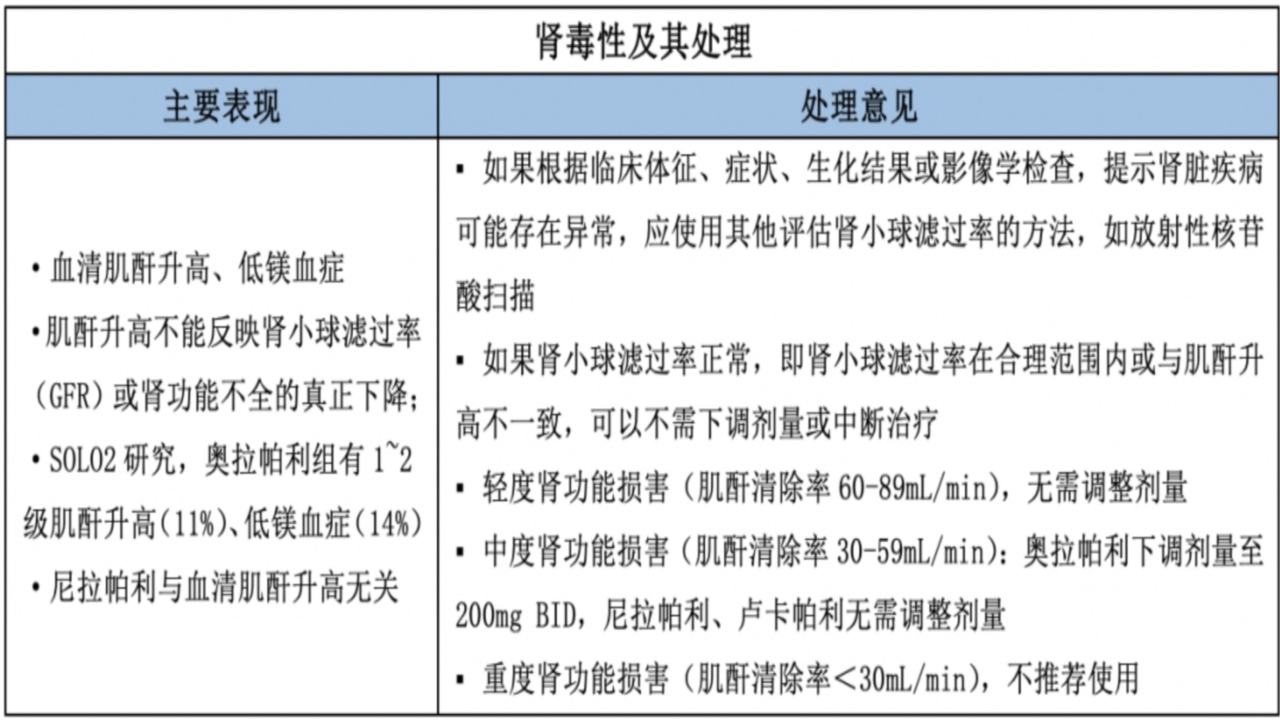
2.肾毒性
机制:抑制了肾脏转运蛋白MATE1、MATE2-K、OCT-1、OCT-2(脱靶效应)。体外研究表明,卢卡帕利强力抑制MATE1和MATE2K并适度抑制OCT-1;奥拉帕利会抑制MATE1、MATE2-K、和OCT-2;从而影响肌酐分泌人近曲小管。
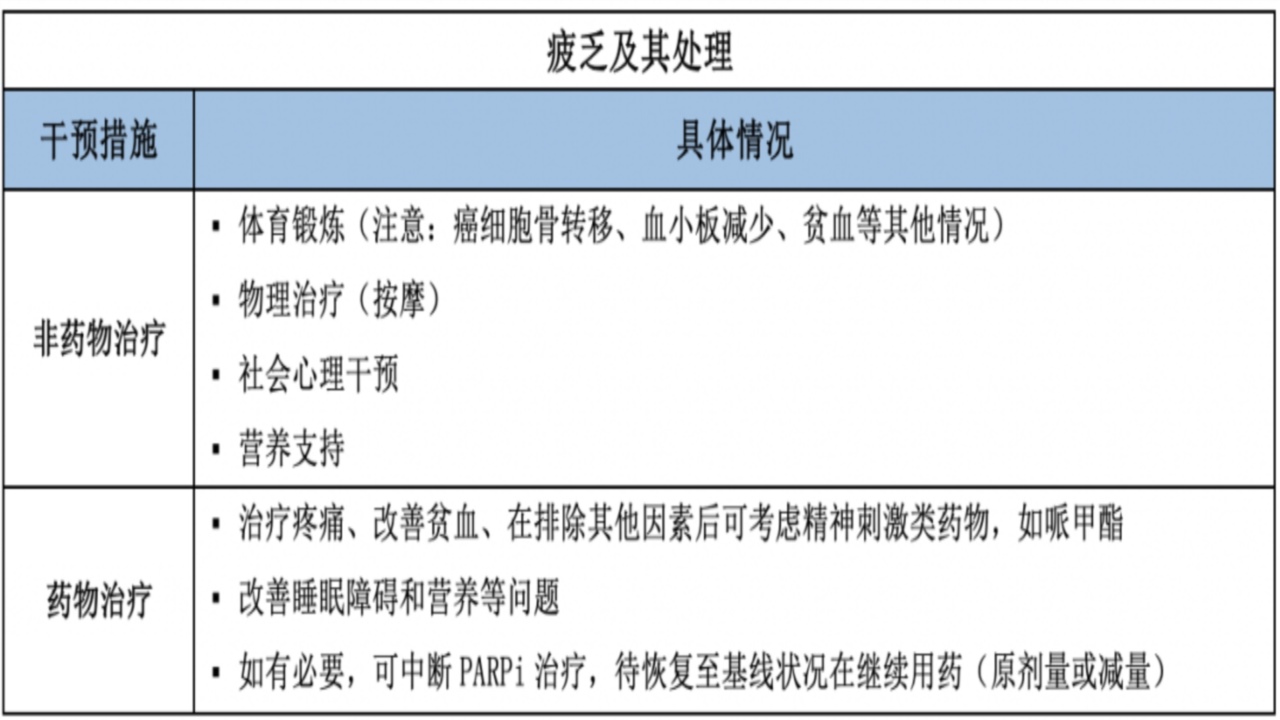
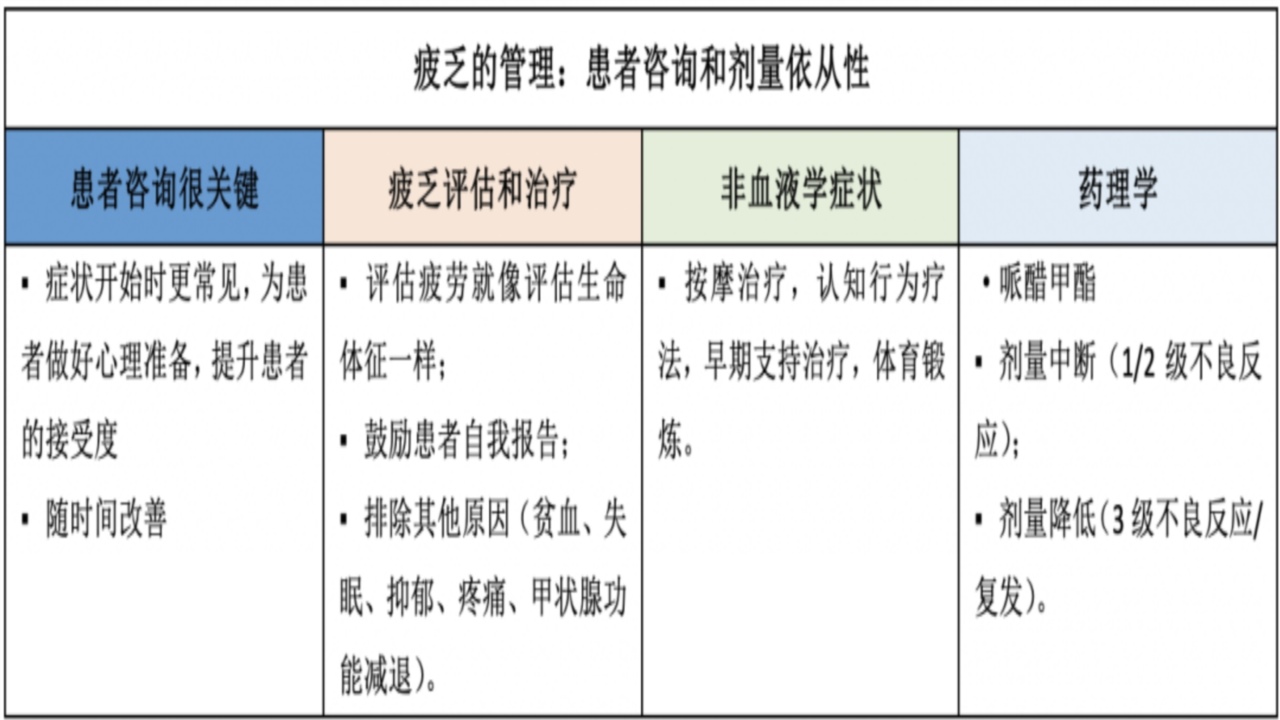
3.疲乏
几乎所有PARPi均会引起疲乏,临床研究中,1~2级疲乏的发生率为52%~62%;3~4级为4%~8%。
三、少见不良反应和处理
包括神经系统毒性、呼吸系统毒性、肌肉骨骼毒性、皮肤毒性、心血管系统毒性、继发性恶性肿瘤。
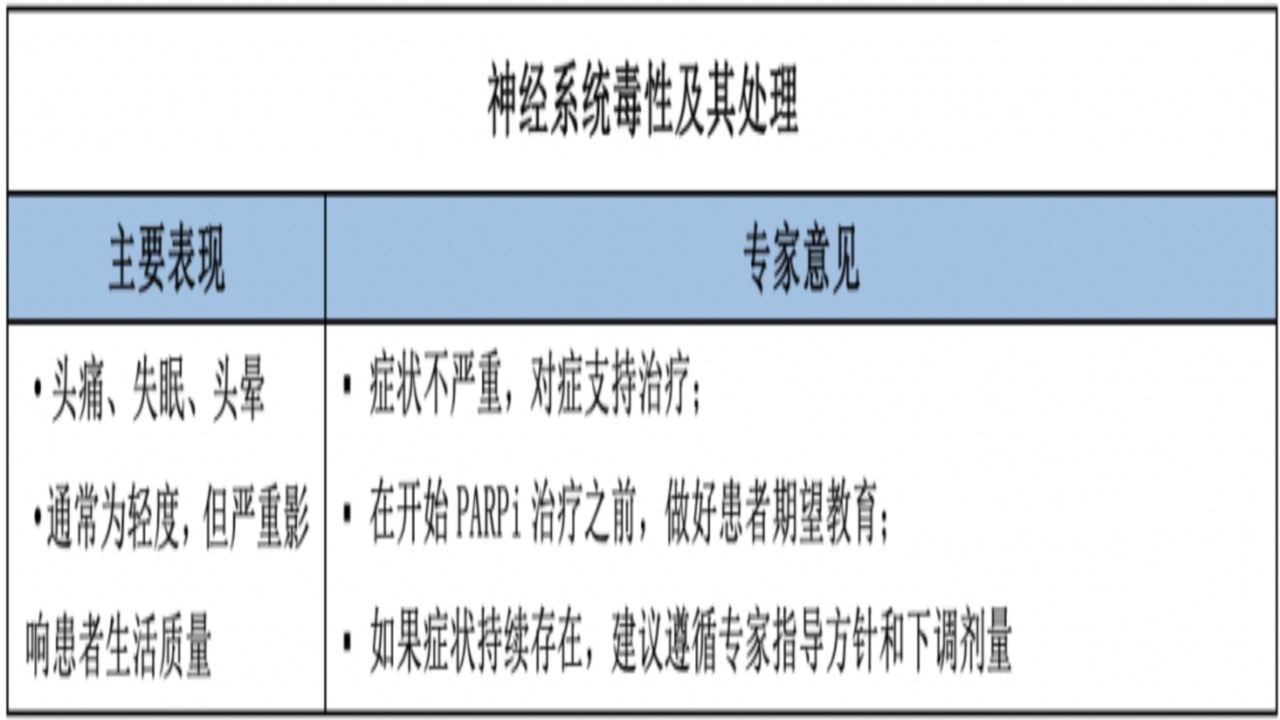
1.神经系统毒性
机制:PARP1在维持昼夜节律基因的转录方面具有重要功能,PARP1的抑制会导致昼夜节律的关键转录成分失联,可能解释PARPi引起的头痛、失眠等神经症状。
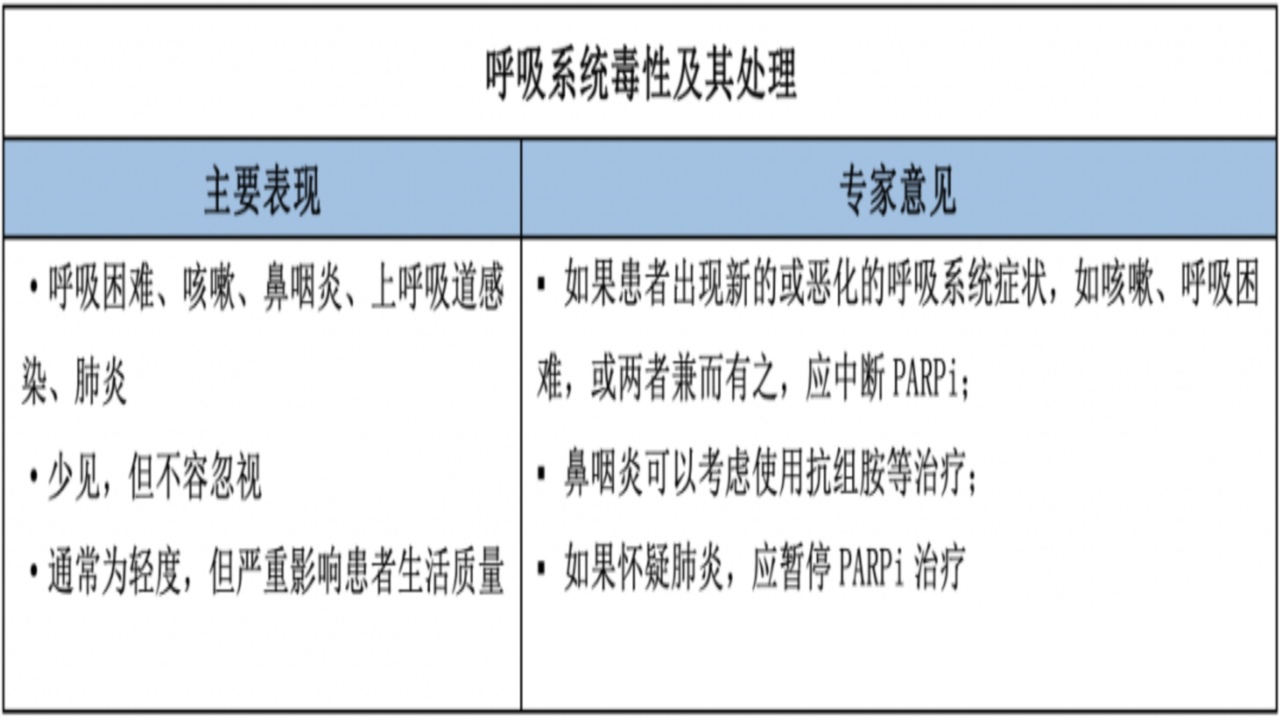
2.呼吸系统毒性
机制:未明
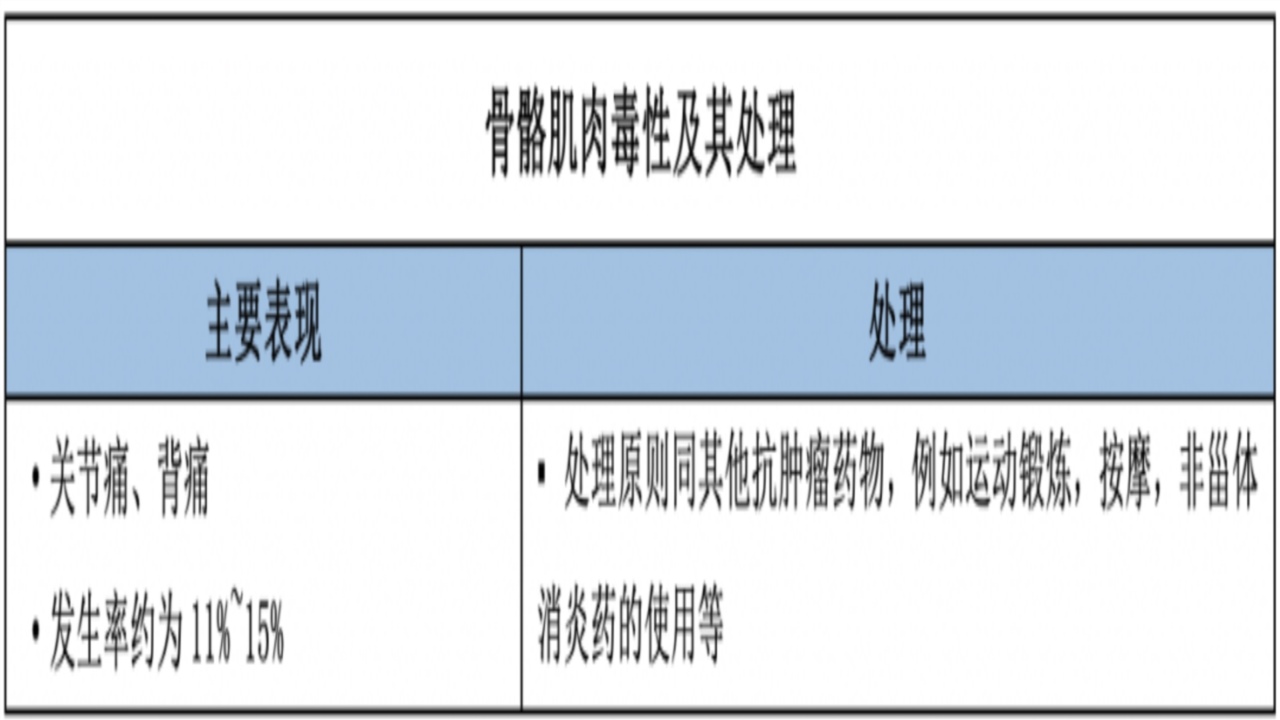
3.骨骼肌肉毒性
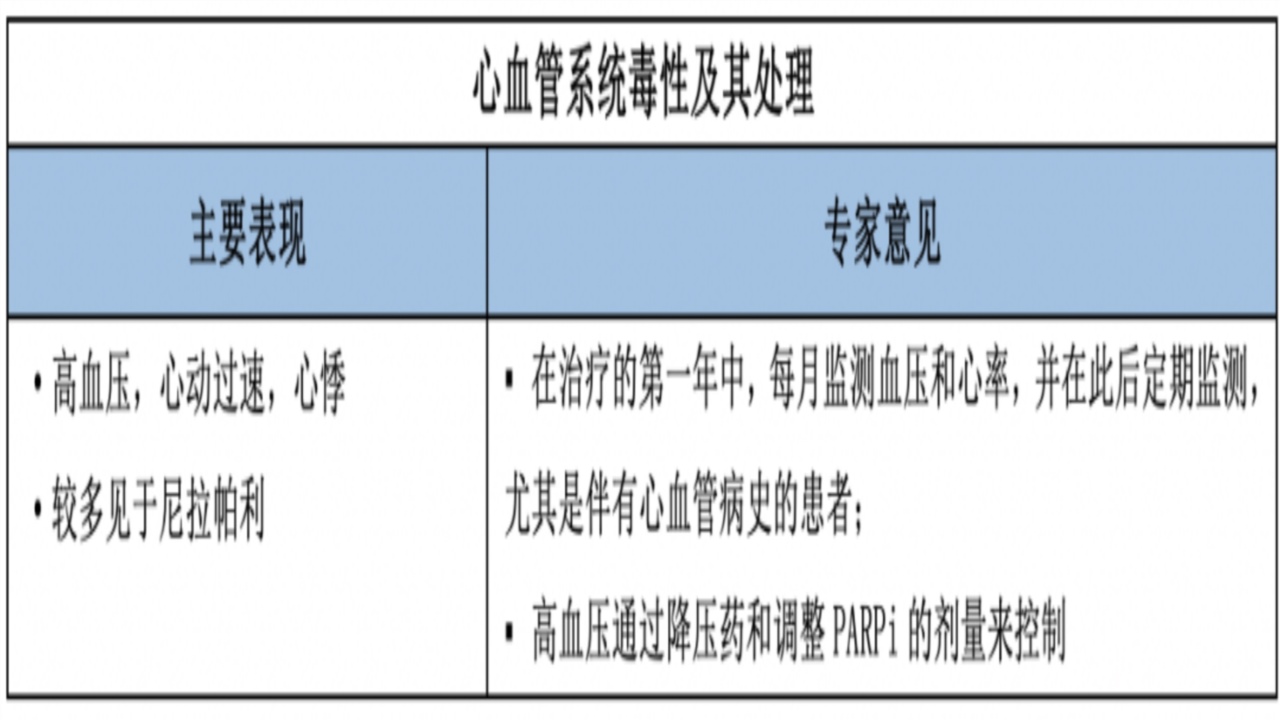
4.心血管系统毒性
机制:未明,可能是脱靶效应,破坏多巴胺和去甲肾上腺素代谢导致。
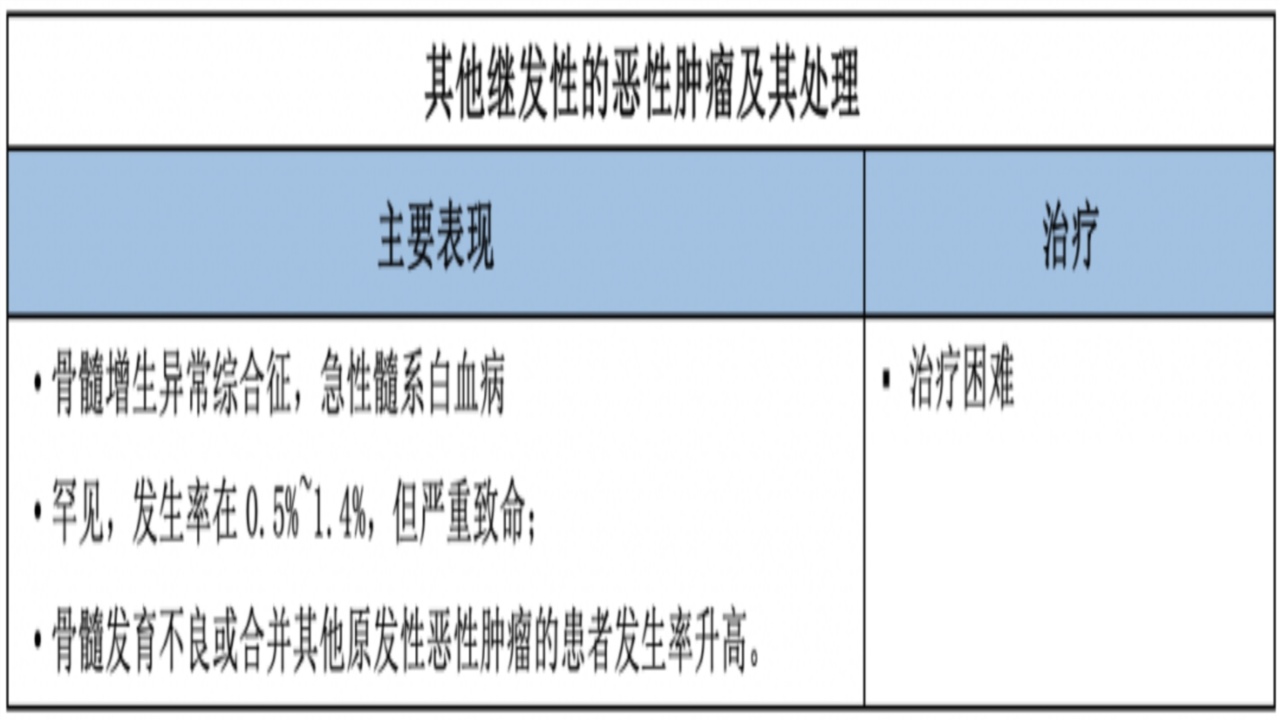
5.继发性恶性肿瘤
骨髓增生异常综合征机制:与PARP抑制的主要作用有关——干扰DNA修复通路。
四、影响PARPi效果的其他因素
临床上,应用PARPi的患者存在依从性差异,一项美国调查显示,26.5%接受PARPi的患者存在依从性不佳,年龄、共病、保险计划或PARPi的起始年对依从性没有显著影响,PARPi药物选择、维持治疗时间长短可能与依从性不佳相关(p<0.05)。因此,针对适合的患者,选择适合药物,或许能够改善患者依从性。
患者是治疗决策的重要环节,诊疗过程中,应当与患者良好沟通、共同决策。一篇发布与新英格兰医学杂志的综述强调了患者作为控制治疗一方,应与医生共同决策治疗的重要性:能够增加患者的知识,减少对治疗的焦虑,改善健康状况,减少治疗和成本的不必要变化,使治疗更符合患者的价值观。
五、总结
PARP捕获能力的高低可能是不同PARP抑制剂不良反应有差异的主要原因;PARP抑制剂的不良事件主要为可管理的1-2级;3级以上不良反应发生率低;因不良反应导致的治疗中断、药物减量或停药等事件较少;出现3-4级不良反应时,中断剂量,待症状恢复至≤1级,恢复原剂量或着减量治疗;让患者了解可能的不良反应,并管理患者预期很重要;同时,坚持常规随访,前12月需要至少每月1次全血细胞检测。
专家简介

陈亮主任
副主任医师,妇产科学博士,妇一科副主任。
山东第一医科大学硕士生导师。
中国抗癌协会妇科肿瘤委员会青年委员会委员。
国家癌症中心宫颈癌质控专业委员会委员。
中国研究型医院学会妇科肿瘤分会青委会委员。
山东省研究型医院协会卵巢癌多学科分子诊疗委员会副主任委员。
山东省疼痛研究会妇产科专业委员会青年委员会常委。
为首承担省级基金3项、省医科院课题1项,发表SCI文章5篇,中华类论文2篇,核心杂志文章多篇。自2009年9月于山东省肿瘤医院工作至今。擅长妇科恶性肿瘤的微创及开腹手术,放化疗等综合治疗。
[声明:本网站所有内容,凡未注明来源为“转载”,版权均归巢内网所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:巢内网”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们]

