
术精于勤|济宁市第一人民医院妇科卵巢癌相关手术系列讲座

王长河 妇科·主任医师
济宁市第一人民医院
编者按:在我国,卵巢癌年发病率居女性生殖系统肿瘤第3位,位于子宫颈癌和子宫体恶性肿瘤之后,呈逐年上升的趋势,而病死率位于女性生殖道恶性肿瘤之首,是严重威胁女性健康的恶性肿瘤。近年来,随着靶向治疗药物在卵巢癌治疗中的应用,卵巢癌的治疗模式发生了巨大的改变,形成了“手术+化疗+维持治疗”的全程管理模式。本文中,山东省济宁市第一人民医院王长河主任对卵巢癌治疗的全程管理进行了详细讲解。
一、卵巢癌传统治疗模式
卵巢癌的传统治疗模式以手术+化疗为主。初次手术包括全面的分期手术及肿瘤细胞减灭术。临床判断为早期的患者应实施全面分期手术,明确最终的分期。临床判断为中晚期患者应行肿瘤细胞减灭术。初次肿瘤细胞减灭术(PDS)是晚期(Ⅲ~Ⅳ期)卵巢上皮性癌(卵巢癌)患者的首选治疗方法。当PDS不能达到满意肿瘤减灭水平和(或)有围手术期高风险因素时,新辅助化疗(NACT)+间歇性肿瘤细胞减灭术(IDS)是合理的替代治疗选择。
卵巢癌治疗有三个70%,一是70%的患者就诊时已是晚期,二是经过规范的初始治疗后,大约70%的患者会在两年内复发,三是随着复发次数和治疗线数增加,患者将从铂敏感变复发为铂耐药复发,在这样的情况下70%的患者会在5年内死亡。
二、卵巢癌治疗新模式
在高效的维持治疗药物出现前,卵巢癌患者经过规范的初始治疗后,只能在随访过程中等待疾病的复发。近年来,随着PARP抑制剂等维持治疗药物的出现和临床应用,为卵巢癌治疗带来了新的希望。维持治疗能够延长患者的无铂间期和PFS,使患者在初始治疗或复发治疗后不必再消极地等待复发。
尽管维持治疗打破了卵巢癌治疗的困局,但手术+化疗仍然是卵巢癌治疗的基石。
三、卵巢癌手术治疗策略
1.早期卵巢癌
对于有生育需求的ⅠA、ⅠC期卵巢上皮癌(低级别浆液性癌、G1子宫内膜样癌),可行单侧附件切除+全面分期手术,保留健侧附件和子宫。对于临床判断为ⅠB期的患者,可行双附件切除+全面分期手术,保留子宫。对于生育需求的早期卵巢癌,可以行全面分期手术。如初次手术没有达到规范的分期手术,建议行再分期手术。
全面分期手术的范围包括全子宫+双附件+大网膜+盆腔淋巴结切除+辅助动脉旁淋巴结切除±阑尾。在横结肠下切除大网膜以及任何肉眼可见病灶;切除双侧盆腔淋巴结和腹主动脉旁淋巴结,在切除盆腔淋巴结时应一起切除髂总血管周围的淋巴脂肪组织,在切除腹主动脉旁淋巴结时,上界至少达肠系膜下动脉水平,争取达肾静脉水平。
2.晚期卵巢癌
经评估有可能达到满意减瘤(残存肿瘤小于等于1cm),建议直接手术。如评估难以实现满意减瘤或年老体弱难以耐受手术者,则在取得细胞学或组织学病理诊断后先行新辅助化疗2~4个周期,一般不超过4周期,评估化疗有效可以满意减瘤再行手术。
无论是PDS还是NACT+IDS,手术达到R0,都是卵巢癌最重要的影响预后的独立因素,也是卵巢癌初始治疗阶段的理想目标。
卵巢癌的生物学行为和转移方式决定了晚期卵巢癌手术不仅仅是一个妇科手术,还需要具备外科手术的能力或良好的外科团队配合(MDT),包括胃肠外科、泌尿外科,肝胆外科等。
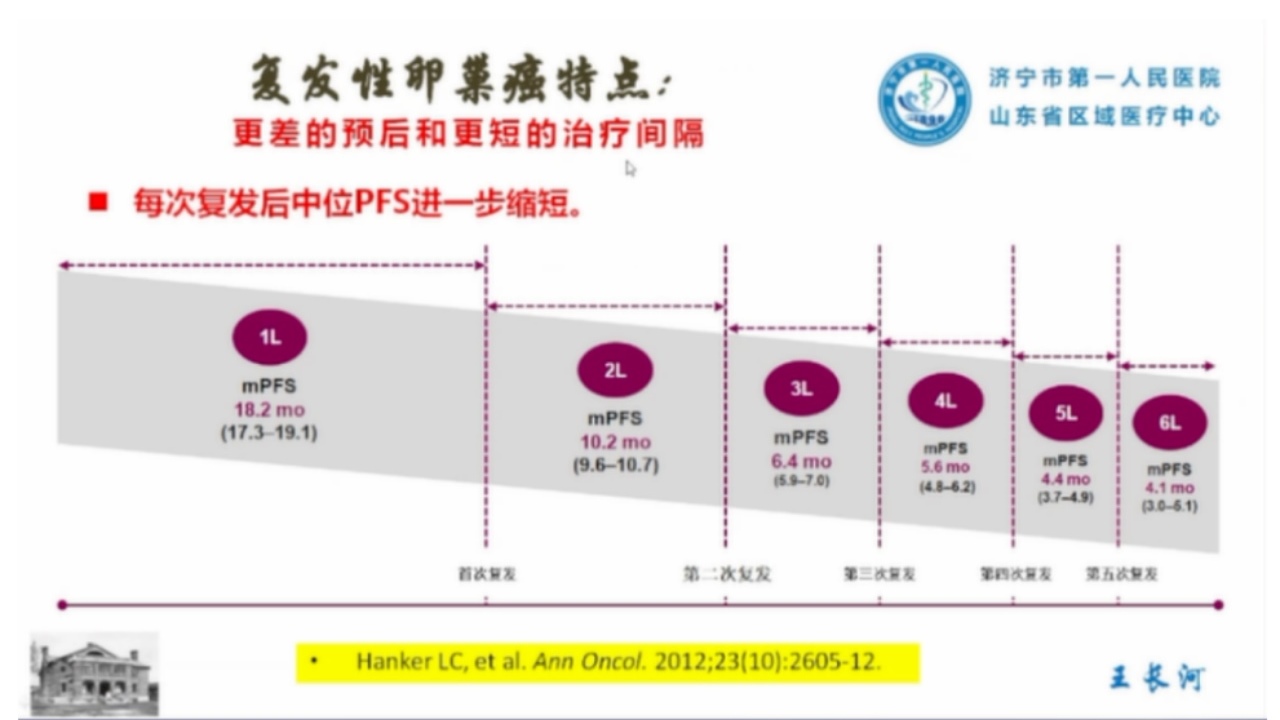
3.复发性卵巢癌
对完成初次或中间型减瘤术并接受化疗后复发患者进行的再次肿瘤细胞减灭术。手术适应证为铂敏感复发患者,即一线化疗末次治疗结束后至复发的间隔时间大于6个月者,且预计复发病灶可以完全切除,达到无肉眼残存肿瘤者,可考虑再次肿瘤细胞减灭术。复发性卵巢癌还可以进行辅助性姑息手术,以缓解病人的痛苦。
4.腹膜后淋巴切除的必要性
对于早期卵巢癌,目前尚无明确证据证明腹膜后淋巴切除能够改善患者生存。FIGO指南把有无淋巴转移作为衡量病期早晚的一个重要参数,使肿瘤分期更为精确,指导术后辅助治疗方案的制定。文献报道,早期卵巢癌盆腔淋巴结受累率为5%~14%,腹主动脉旁淋巴结受累率为4%~12%。
晚期卵巢癌的治疗建议行肿瘤细胞减灭术,主要原则是尽最大可能切除原发灶和转移灶。但系统性淋巴结切除是否应纳入肿瘤细胞减灭术,是否具有治疗价值,尚存争议。斯坦福大学Berek教授指出,仅有腹膜后淋巴结转移而没有腹膜转移的卵巢癌患者总体生存率高达58%~84%,而肉眼存在腹膜转移的卵巢癌晚期患者的生存率仅为18%~36%。
FIGOⅢ~V期卵巢癌患者,如果盆、腹腔能达到满意肿瘤细胞减灭术(残留病灶直径小于1cm)RO,应予以系统性淋巴结切除或至少切除肿大淋巴结。如果盆、腹腔残留病灶直径大于2cm,可以考虑不行淋巴结切除术。
5.卵巢癌可切除性评估
卵巢癌常用的可切除性评估的方法包括Suidan评分、FAGOTTI评分和梅奥标准。
Suidan评分
根据Suidan评分可以评估患者是否能耐受手术,如果Suidan评分小于等于3分,评估病灶可以达到R0切除就可以直接手术。如果Suidan评分大于等于3分,手术难度比较大,则可以先化疗,然后再行中间型肿瘤细胞减灭术。
FAGOTTI评分
FAGOTTI评分也可以评价先手术还是先化疗。该评分主要是根据腹腔镜下病灶的情况进行估分,准确性为77.3%~100%。当腹腔镜预测分数小于8分可以行PDS,分数大于等于8分时不满意PDS可能性为100%,建议行NACT+IDS。
Suidan评分和FAGOTTI评分是常用的评价方式,虽然有一定量化值,但是往往还根据手术的意愿去评价,有一定的主观性。
梅奥标准
美国梅奥医学中心应用PDS术后发生严重并发症与死亡的高风险来确定不适合行PDS的患者。符合以下三条标准其中一条,则定义为高风险患者:①白蛋白小于3.5g/dL。②年龄大于等于80岁。③年龄75-79岁且伴以下一种因素:如ECOGPS大于1(ASA评分3-4)、IV期或者预估手术较复杂。
四、卵巢癌新辅助化疗
NACT适用于经体检和影像学检查评估或手术探查(包括腹腔镜探查)评估,难以达到满意减瘤的Ⅲ/IV期患者,特别是大量胸腹水者,其不适用于早期病例。
此外,还适用于对化疗敏感的高级别浆液性癌或子宫内膜样癌,不适用于对化疗不敏感的低级别浆液性癌、粘液性癌和交界性肿瘤以及性索间质肿瘤。
NACT前应通过细针穿刺或腹腔镜活检取得组织病理学证据,对特殊病例,临床高度怀疑卵巢癌,但无法取得组织病理活检者,则必须有腹水细胞学诊断,且血清CA125/CEA(比值)大于25。
NACT3~4个疗程后,应考虑IDS。方案与术后辅助化疗的一线方案相同,紫杉醇联合卡铂是标准的首选方案,需要注意的是,NACT期间需慎用贝伐单抗。
五、卵巢癌维持治疗
维持治疗是指卵巢癌完成既定的手术或化疗后达到最大限度临床缓解(完全或部分缓解)后,继续应用化疗药物或靶向药物进行的治疗,治疗的目的是延缓复发,延长PFS和OS。
卵巢癌维持治疗分为一线维持治疗和二线维持治疗。针对新诊断卵巢癌患者初始治疗达到完全缓解或部分缓解后的维持治疗称为一线维持治疗,针对复发卵巢癌患者治疗后达到完全缓解或部分缓解后的维持治疗称为二线维持治疗。
一线维持治疗方面,SOLO-1研究、PAOLA-1研究和PRIMA研究均证实了PARP抑制剂一线维持治疗的有效性。
复发性卵巢癌的维持治疗,主要针对铂敏感复发患者,铂耐药患者尚缺乏相关数据。STUDY19研究、NOVA研究和ARIEL3研究也证实了PARP抑制剂能显著改善铂敏感复发性卵巢癌的PFS,使铂敏感复发患者获益。
对于既往接受过大于2线以上的治疗的患者,包括既往使用过PARP抑制剂的患者,在疾病进展后是否可以继续使用PARP抑制剂是目前临床热点问题。基于目前有限的数据,暂不推荐PARP抑制剂再次使用。
[声明:本网站所有内容,凡未注明来源为“转载”,版权均归巢内网所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:巢内网”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们]

精彩回放

卵巢癌肿瘤细胞减灭术--胃肠道相关手术
卵巢癌的初始治疗两大原则: “以手术为主,辅以化疗、放疗、靶向等的综合治疗”, “以手术为基础,联合化疗为主要治疗的综合治疗”。 肠道是晚期卵巢癌最常见的转移部位; 肠道转移病灶的手术处理是关系预后的重要因素; 胃肠道手术是妇科肿瘤医师应该具备的技能。

卵巢癌肿瘤细胞减灭术--卷地毯式子宫+双附件+直肠部分切除术+肠吻合术
盆腔手术是卵巢癌肿瘤细胞减灭术的重要组成部分,卵巢癌盆腔病灶借助于熟练的手术技巧或MDT手术团队,盆腔局部R0切除是可以实现的。
