
大爱无疆|妇科肿瘤诊治新进展及康复管理系列讲座

孔为民 妇科肿瘤·主任医师
首都医科大学附属北京妇产医院
编者按:子宫内膜癌治疗以手术为主,放疗和化疗是常用的辅助治疗方式。制定治疗方案应结合患者的年龄、病理学类型和分子分型、临床(影像)分期、高危因素和体能状态等综合考虑决策。今天我们分享首都医科大学附属北京妇产医院妇瘤科孔为民教授在大爱无疆|妇科肿瘤诊治新进展及康复管理系列讲座授课视频整理成的文章,我们来一起学习吧。
复习:宫颈癌术后的危险因素及辅助治疗
1.危险类型的划分
(1)高危因素:淋巴结转移;宫旁转移(FIGO包括肿瘤侵及筋膜层);阴道切缘阳性。合并高危因素的早期宫颈癌患者,术后复发率约为35%-40%。
(2)中危因素:宫颈间质浸润深度大于等于1/2;淋巴脉管间隙受累(LVSI);肿瘤最大径线大于等于4cm。独立的中危因素并不增加复发率,但合并出现时可使患者复发率增加至15%-20%。
(3)低危因素:除高危因素和中危因素外,均为低危因素。
2.早期宫颈鳞癌术后高危因素
(1)“三大”:淋巴结转移;宫旁转移;阴道切缘阳性。
(2)“三小”:宫颈深部间质受侵;淋巴脉管间隙受累(LVSI);肿瘤局部病灶较大(大于等于4cm或者5cm)。
3.术后伴有高危因素患者的处理
(没有争议)
(1)淋巴结转移:体外照射+同步化疗。
(2)宫旁转移:体外照射+同步化疗。
(3)阴道切缘阳性:腔内放疗±体外照射。
4.术后伴有中危因素患者的处理
(存在争议)Sedlis标准
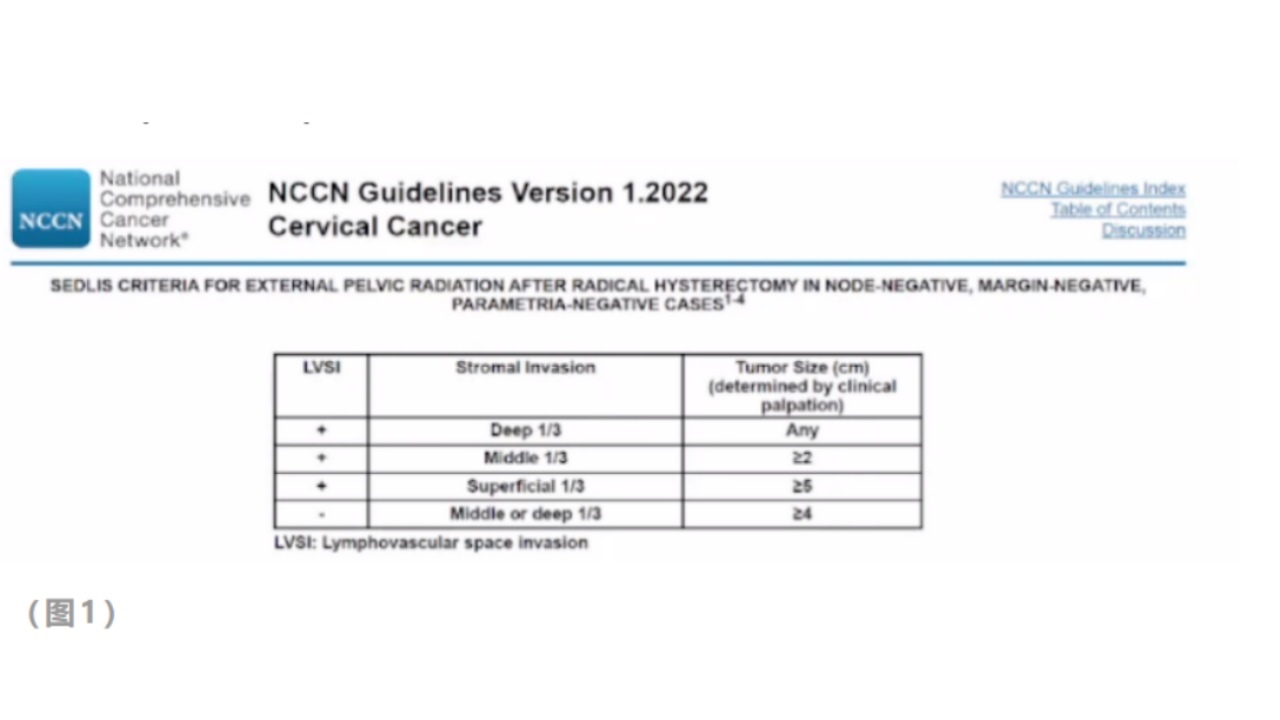
GOG-92试验表明,与观察组相比,辅助全盆放疗改善了1B期宫颈癌患者和不同风险因素水平患者的无复发生存期,并使OS获益。
5.四因素模型
2014年一项关于早期宫颈癌术后中危因素的研究提到,选择术后辅助治疗时可参考“四因素模型”,该研究结果指出四因素包括:肿瘤最大径线大于3cm;淋巴脉管间隙浸润(LVSI);肿瘤侵犯宫颈外1/3间质;病理类型为腺癌。
存在上述任何两个因素,术后加放疗均有益。
一、子宫内膜癌术后辅助治疗的三种情况
1.ⅠA期
G1/G2:首选观察;并LVSI和(或)年龄大于等于60岁考虑阴道近距离放疗。
G3:首选阴道近距离放疗;无肌层浸润时考虑观察;年龄大于等于70岁或LVSI考虑外照射放疗(2B级)。
2.ⅠB期
G1:首选阴道近距离放疗;年龄小于60岁且无LVSI时考虑观察。
G2:首选阴道近距离放疗;年龄大于等于60岁和(或)LVSI考虑外照射放疗;年龄小于60岁且无LVSI时考虑观察。
G3:放疗(外照射放疗和(或)阴道近距离放疗)±系统治疗(系统治疗为2B级证据)。
3.Ⅱ期
首选外照射放疗和(或)阴道近距离放疗±系统治疗(系统治疗为2B级证据)。
4.Ⅲ、Ⅳ期
分期手术后推荐行系统治疗±外照射放疗±阴道近距离放疗。
5.小结
(1)对于Ⅰ期,如果存在两个危险因素,强烈建议阴道近距离放射治疗。
(2)对于Ⅱ期G1/G2、小于等于50%肌层浸润、无LVSI、镜下宫颈浸润,阴道近距离放疗也是一种选择。
(3)Ⅲ期及以上首选联合治疗,以系统治疗为主。
6.Ⅱ期子宫内膜癌患者术后可以观察吗?
一项针对Ⅱ期子宫内膜癌的多机构研究发现
(1)对于疾病特异性生存期,LVSI和肿瘤组织学级别高是显著的预测因子;而年龄较大和肿瘤组织学级别高是总生存期的唯一预测因子。
(2)肿瘤分级高、淋巴脉管间隙浸润、辅助放疗和高龄是重要的预后因素。
因此,对于Ⅱ期患者,如行根治性切除术(广泛子宫切除+盆腔淋巴结清扫+双附件切除+腹主动脉旁淋巴结清扫)后切缘阴性且无宫外转移,可观察或行阴道近距离放疗。
(二)Ⅱ型内膜癌术后辅助治疗
1.Ⅱ型内膜癌病理类型
(1)子宫浆液性癌:多表现为复杂的乳头和/或腺样结构,伴有弥漫而明显的核多形性;多有P53突变,Ki67指数较高。
(2)子宫透明细胞癌:多为胞质透明的多角形或鞋钉样细胞。
(3)癌肉瘤:既含恶性上皮成分,又含恶性间质成分;常形成大息肉充满宫腔。
(4)未分化/去分化癌:是一种分化方向不明确的上皮性恶性肿瘤。未分化癌同时合并低级别子宫内膜样腺癌,这提示肿瘤的去分化过程,2006年Silva等把这类子宫内膜归类为去分化癌。
2.浆液性癌/透明细胞癌术后辅助治疗
根据病理结果决定后续治疗:
(1)无残留病灶:观察。
(2)非浸润性ⅠA期(局限于子宫内膜):腹腔冲洗液细胞学阴性,首选阴道近距离放疗观察;腹腔冲洗液细胞学阳性,则系统治疗+阴道近距离放疗。
(3)浸润性ⅠA期、ⅠB期、Ⅱ期(侵犯子宫肌层、间质):系统治疗±盆腔外照射放疗±阴道近距离放疗/外放疗±阴道近距离放疗。
(4)Ⅲ期/Ⅳ期:系统治疗±外放疗±阴道近距离放疗(建议对晚期/转移性疾病行HER2检测,其靶向药是赫赛汀)。
3.癌肉瘤术后辅助治疗
根据病理结果决定后续治疗:
(1)ⅠA期:系统治疗+阴道近距离放疗*±盆腔外照射放疗。
*应考虑术后3-6周内开始化疗,阴道近距离放疗可与术后6周开始的化疗交叉进行。
如子宫肿瘤中大于50%为肉瘤成分,且上皮成分为高级别病变,可考虑盆腔外照射放疗。
(2)ⅠB~Ⅳ期:系统治疗±外照射放疗±阴道近距离放疗。
化疗方案的演变:IP(异环磷酰胺+顺铂)→TC/TP(紫杉醇+卡铂/顺铂)(目前TC临床应用更广泛)。
4.未分化/去分化癌术后辅助治疗
无论分期如何,术后均行系统治疗±盆腔外照射放疗±阴道近距离放疗。
(三)子宫内膜样癌不完全分期术后辅助治疗
1.ⅠA期+G1-G2+LVSI阴性+年龄小于60岁,可观察。
2.ⅠA期+G3+LVSI阴性+年龄小于60岁+无肌层浸润,可观察。
3.ⅠA期+G3(或ⅠB期+G1-G2)+LVSI阴性+年龄大于等于60岁,且影像学检查(CT、核磁共振)阴性,则选择阴道近距离放疗。
4.ⅠA期+G1-G3+LVSI阳性、ⅠB期+G1-G2+LVSI阳性、ⅠB期+G3±LVSI阳性、Ⅱ期,需进行影像学检查。若为阴性,则按完全手术分期后处理。若为(可疑)阳性,需再分期手术/对转移灶进行病理确诊,并根据病理结果制定治疗方案。
5.ⅢA期及以上,推荐行系统治疗±外照射放疗±阴道近距离放疗。
二、子宫内膜癌术后辅助治疗的十个问题
(一)子宫内膜癌术后病理我们要关注什么?
1.目前指导子宫内膜癌治疗及预后的临床病理参数有组织学类型、分级、分期、年龄和LVSI等。
2.Ⅲ/Ⅳ期子宫内膜癌患者应考虑雌激素受体(ER)。
3.Ⅲ/Ⅳ期子宫浆液性癌患者建议HER2Neu检测,以确定辅助化疗是否加入曲妥珠单抗(AI)。
4.应对所有子宫内膜癌进行错配修复状态(MMR)和/或微卫星不稳定性(MSI)检测,以筛选Lynch综合征,有利于确定免疫检查点抑制剂帕博利珠单抗单药或联合乐伐替尼治疗。
5.对于子宫内膜癌晚期患者应进行分子分型检测,以确定是否存在TP53突变,指导治疗决策。
6.尽量进行生物标志物检测。
7.推荐所有子宫肿瘤患者,初始治疗时进行全面的基因组分型,包含:
(1)POLE
(2)MSI/MMRd
(3)雌激素受体(estrogenreceptor,ER)/孕激素受体(progesteronereceptor,PR)
(4)人表皮生长因子受体2(humanepidermalgrowthfactorreceptor2,HER2)
(5)神经营养因子受体络氨酸激酶(NeuroTrophinReceptorKinase,NTRK)
(6)肿瘤突变负荷(TumorMutationalBurden,TMB)
(7)BRCA等。
8.国内的基因检测状态和我们的态度(像晚期卵巢上皮性癌那样应检尽检?)
由于90%子宫内膜癌的预后较好,建议Ⅲ期以上的患者再进行基因检测。
(二)子宫内膜癌预后危险因素有哪些?
1.子宫内膜癌术后危险因素(辅助治疗依据)
(1)手术病理分期、病理类型。
(2)组织学分级(G1,2,3,也可分为低级别和高级别)。
(3)年龄(60还是70岁为界?)、淋巴脉管间隙受侵(LVSI)、子宫肌层受侵,宫颈间质受侵,淋巴结转移,病灶大小(2cm?),子宫下段受侵(?)等。
2.FIGO建议采用四个主要组织病理学标准来确定高危疾病:
①低分化(G3);②LVSI(特别是实质性/弥漫性);③非子宫内膜样病理学类型(浆液性、透明细胞、未分化、小细胞、癌肉瘤);④宫颈间质受累。
3.子宫内膜癌复发风险分级(FIGO指南,2021)
(1)低危患者(G1或G2、无肌层浸润或浸润浅肌层)和仅有一个高危因素者。
(2)中危患者(至少有2项高危因素)。
(3)高危患者(G3和深肌层浸润和/或LVSI、高危组织类型、不良分子分型)。
4.GOG定义了高中危组
(1)G2/G3、LVSI、外1/3肌层侵犯。
(2)年龄50岁以上有上述两项危险因素。
(3)年龄70岁以上有上述任何危险因素。
(4)其他情况均属低中危,透明细胞癌或浆液性癌属于高危。
5.欧洲肿瘤年会ESMO提出的风险分层(2014年)(推荐)
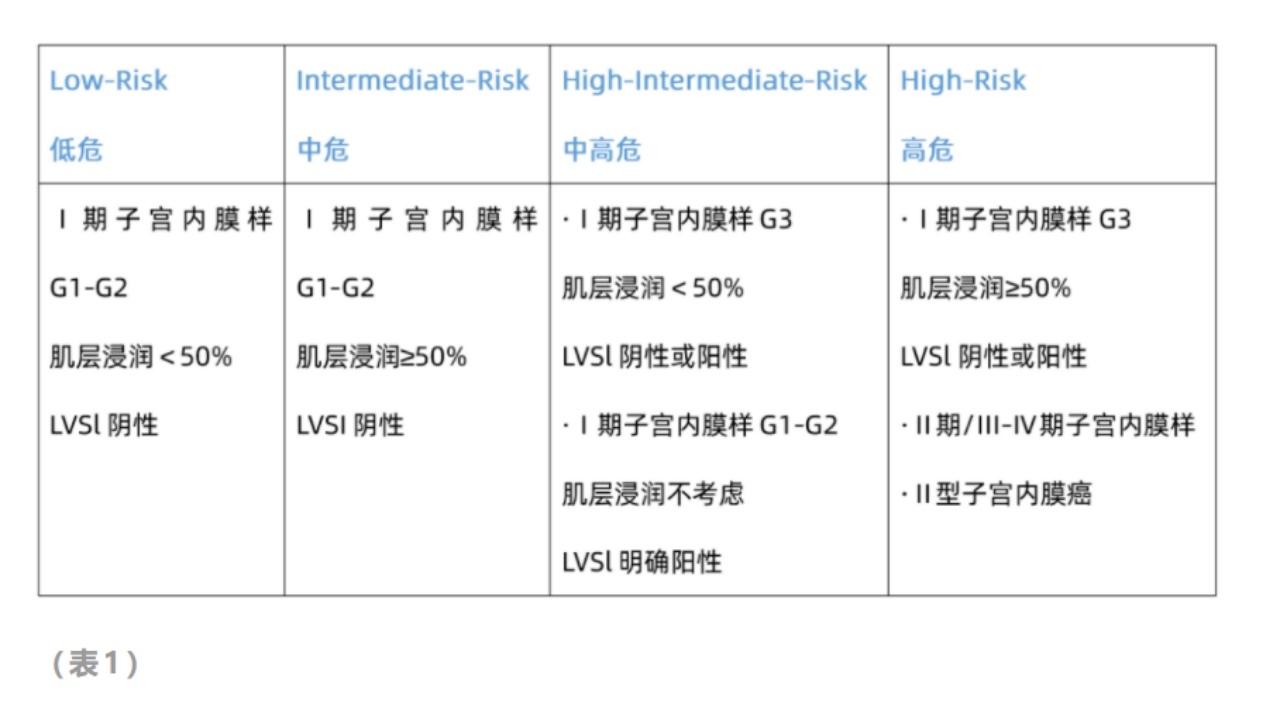
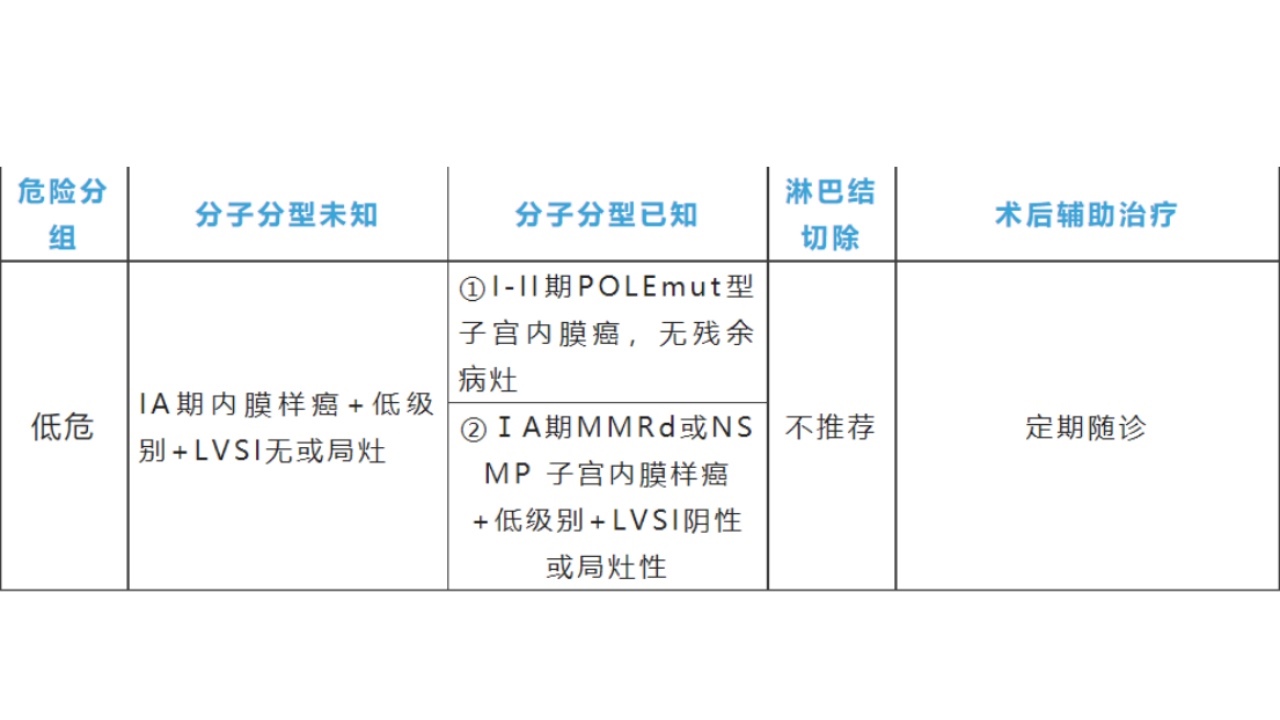
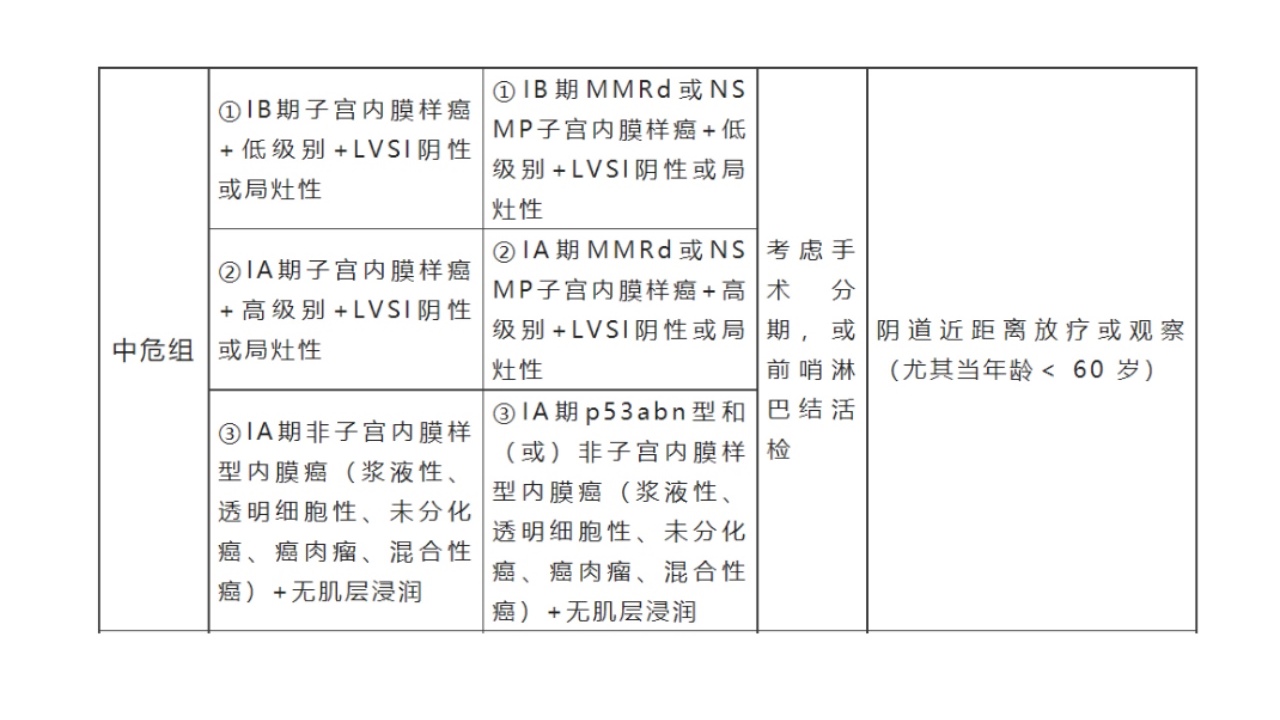
6.近来,在前述ESMO疾病危险度分层基础上,结合子宫内膜癌分子分型将内膜癌预后风险进行了再分组(见下表),这是目前最成熟也是最难记的预后风险分组。
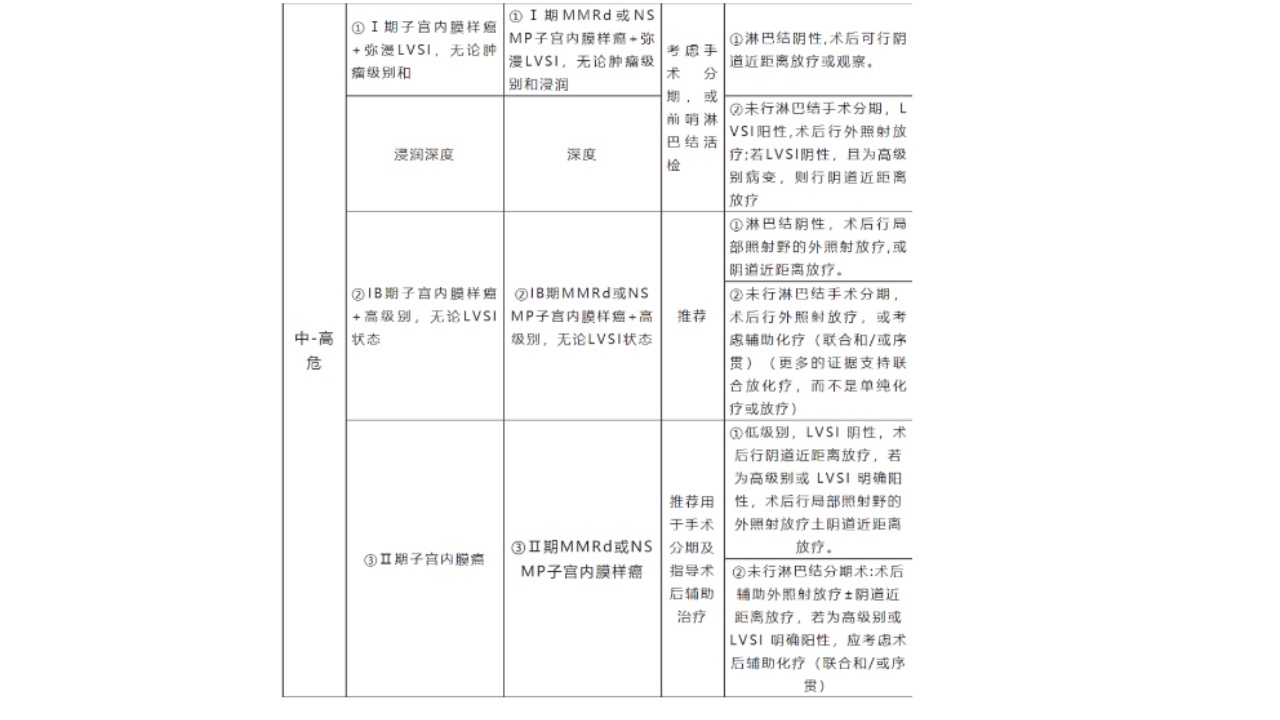
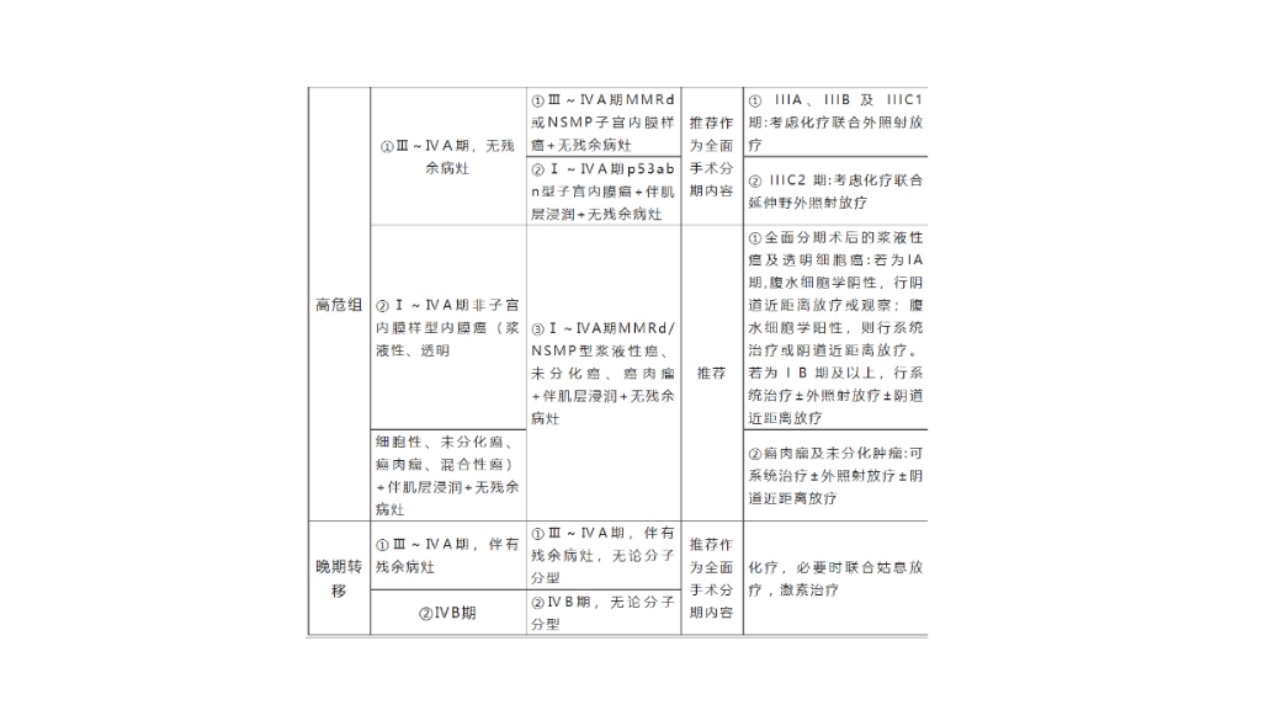
(三)子宫内膜癌术后化疗能取代放疗吗?
1.MaggiR等的研究报道,放疗组及化疗组的无进展生存率及总生存率无差异,但是放疗局部控制较好,而化疗远处控制较好。
2.JGOG-2033试验表明两组的生存率无显著差异,化疗组的严重并发症无明显增加。化疗组高中危病人的无进展生存率及总生存率好于放疗组。结果有待进一步研究证实。
3.国内温宏武等也回顾性研究了106例早期内膜癌患者(分为有术后化疗和无术后化疗两组),结果显示,术后辅助性化疗可以提高有高危因素的早期内膜癌的预后。
4.目前还缺少多中心大样本的研究。我们建议:内膜癌术后不常规用化疗,但是某些情况下,征得患者知情同意情况下可用(无放疗设备、年轻患者、术后肠梗阻患者等)。
(四)序贯放化疗与同步放化疗孰优孰劣?
1.根治性放疗中同步放化疗的应用

2.晚期子宫内膜癌术后的序贯治疗(sequentialmultimodalitytherapy)也称三明治疗法(“sandwich”regimens),经典应用方法:化疗+放疗+化疗。
3.目前子宫内膜癌序贯放化疗的研究较为活跃,并认为是可能会产生积极结果的治疗方案之一。
(1)理论基础(相对于术后化疗+放疗);
(2)病人身体的承受能力和依从性(相对于同步放化疗);
(3)其他肿瘤,如乳腺癌、肺癌,该治疗方案的疗效、副作用观察。
4.子宫内膜癌序贯放化疗的应用体会
(1)1-2个疗程化疗,如TC等。
(2)放疗:盆腔外照射±腔内后装治疗。
(3)2-4个疗程化疗,方案同前。
(4)仅用于ⅢC期以上患者(尤其是广泛淋巴结转移,特别是腹主动脉旁淋巴结转移)。
(五)分子分型如何指导术后辅助治疗
1.分子分型有何意义?
(1)预测预后:2013年,癌症基因图谱(TheCancerGenomeAtlas)项目对373例子宫内膜癌进行了大规模、全面、整合性基因组分析,对肿瘤分类提出了新的分子见解,确定了子宫内膜癌分为四个分子亚组。
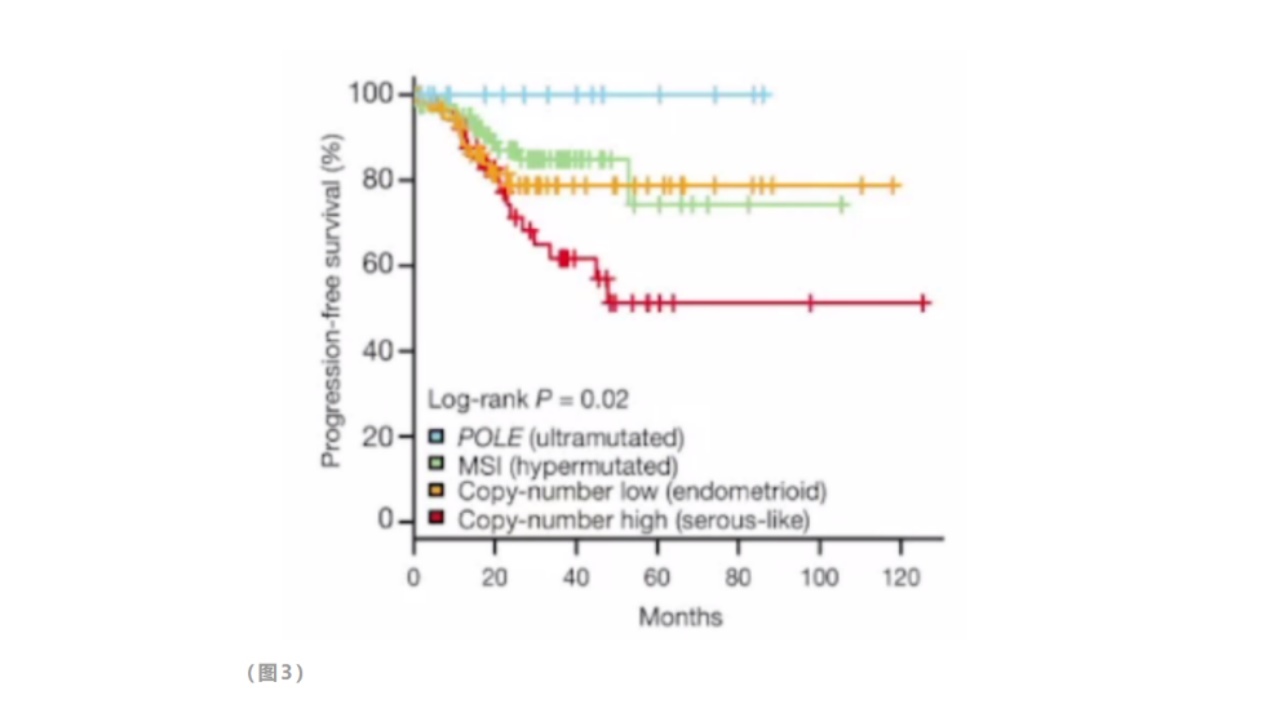
POLE超突变型(POLEultramutated):预后最好;微卫星不稳定(MSIhypermutated):预后居中;低拷贝型(copy-numberlow/endometrioid):预后居中;高拷贝型(copy-numberhigh/serous--like):预后最差。
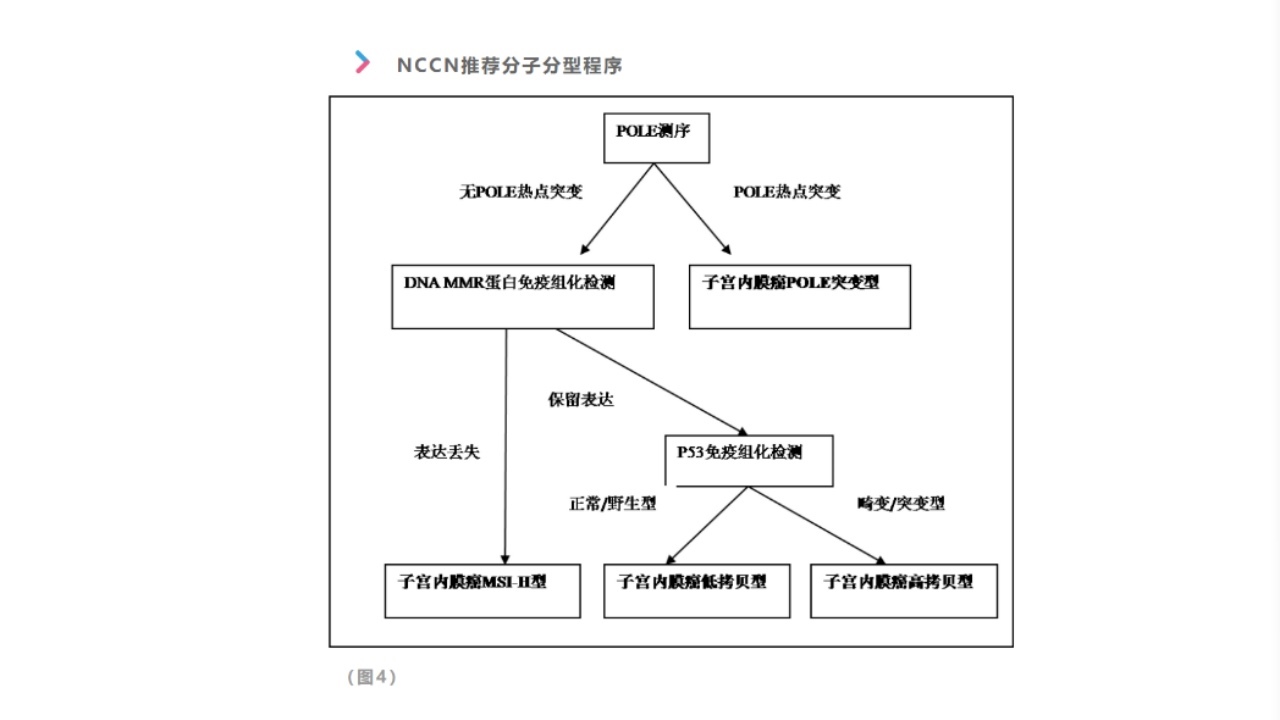
(2)指导治疗:2021年ESGO(欧洲妇科肿瘤协会)/ESTRO(欧洲放射肿瘤学会)/ESP(欧洲病理学会)共同发布了子宫内膜癌管理指南,对子宫内膜癌建立以分子分型为基础的预后风险分级模式。
①低危子宫内膜癌的辅助治疗
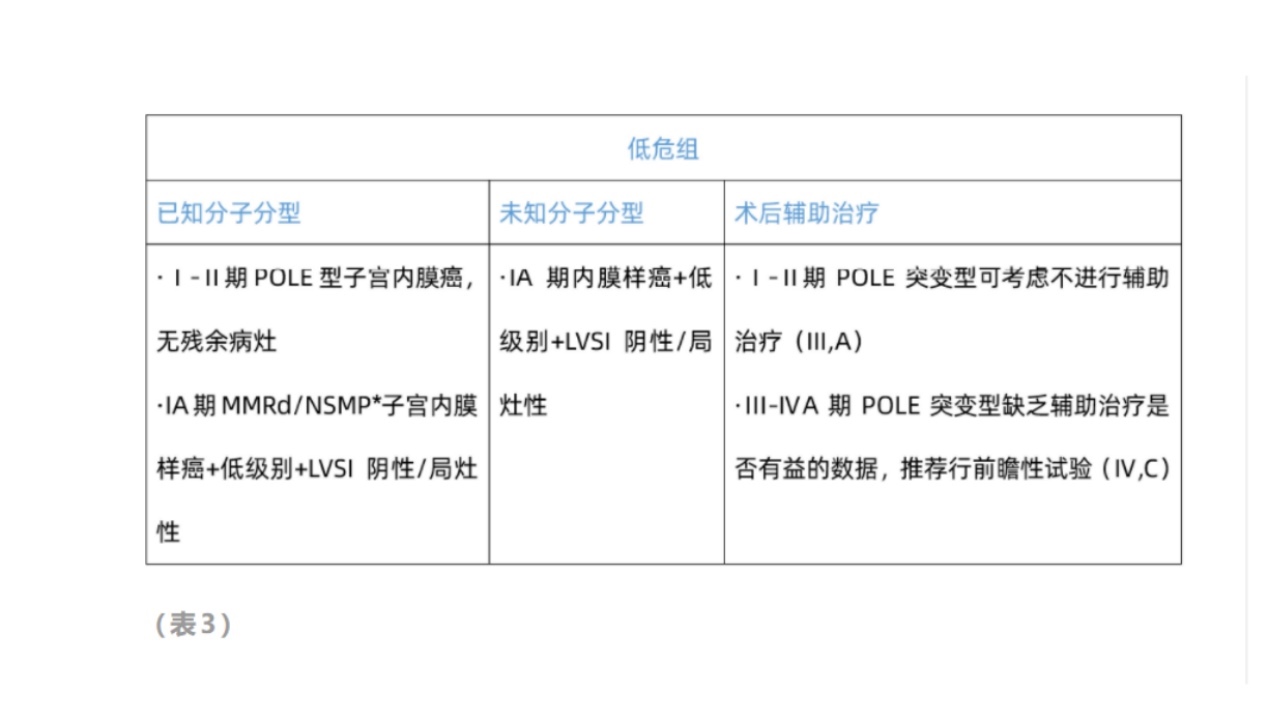
对于低风险子宫内膜癌患者,不建议进行辅助治疗(ⅠA)。
PROTEC-3:对于Ⅲ期及以上POLE突变型患者,同步放疗与放疗效果均较好。
对于Ⅲ期患者,只有间接数据,因为所有晚期疾病患者都接受了辅助治疗,因此推荐前瞻性试验。
无特定分子谱系(NSMP);错配修复缺陷(MMRd)
②中危子宫内膜癌的辅助治疗
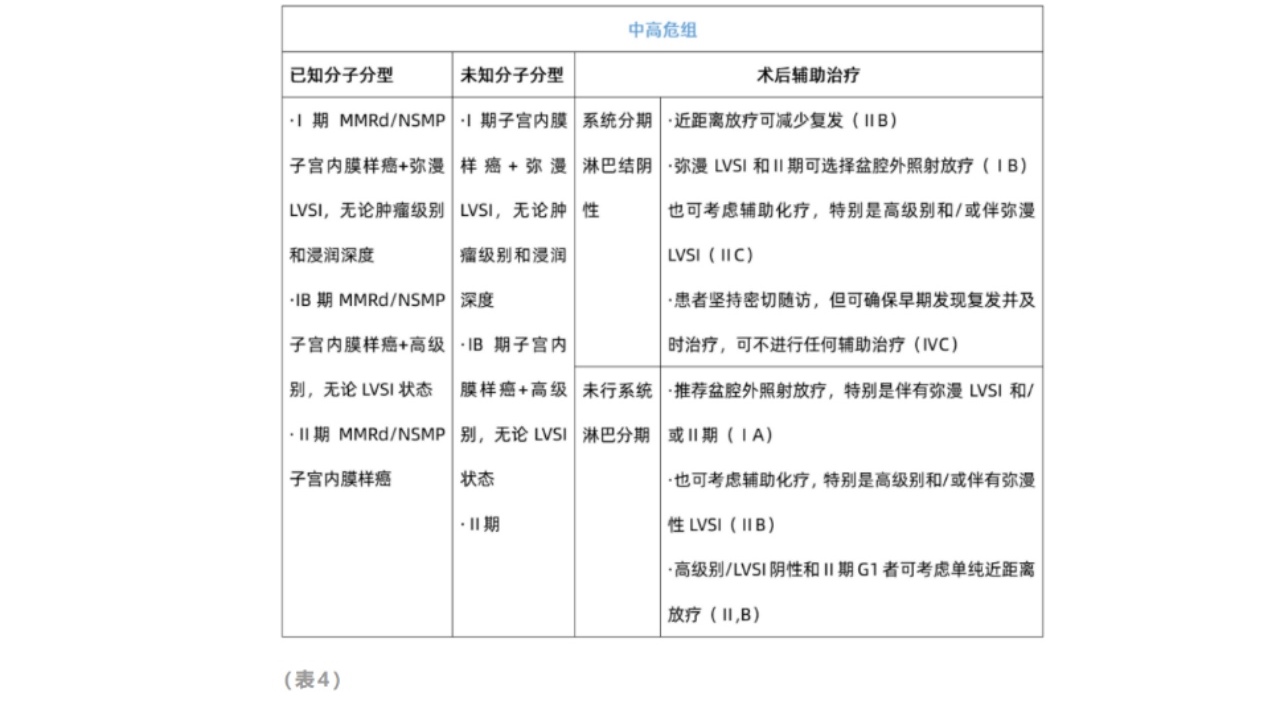
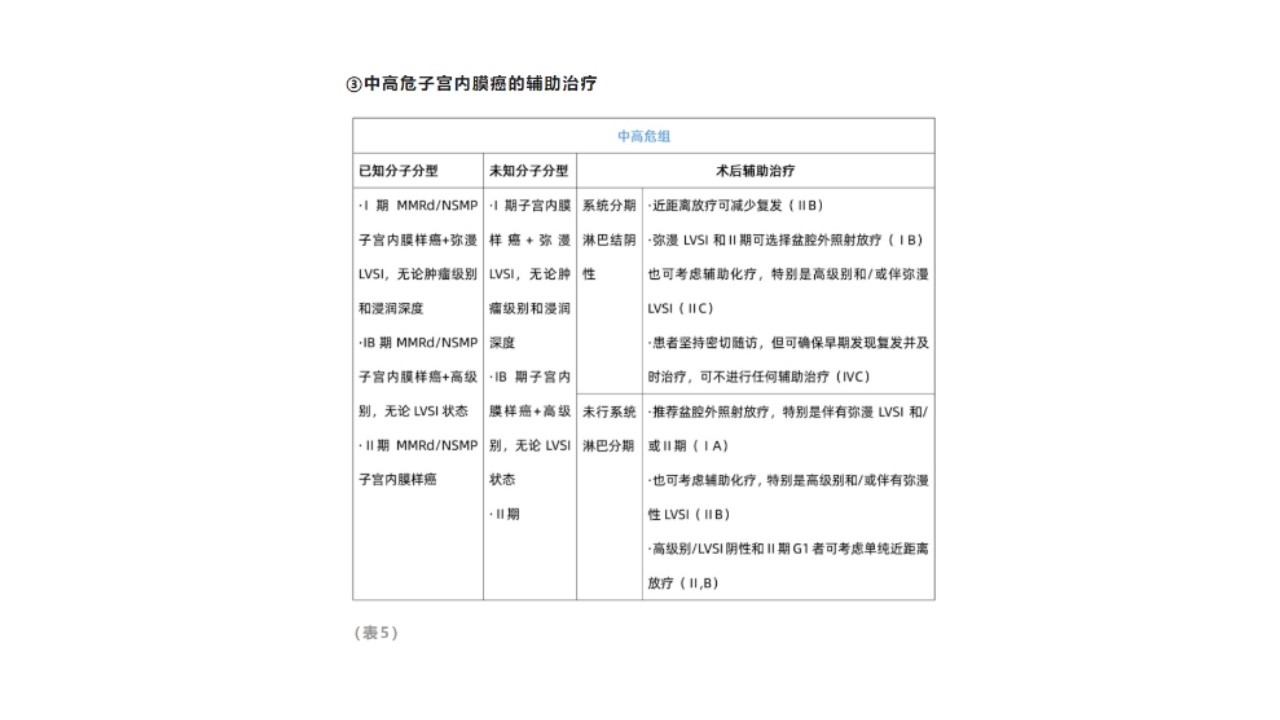
GOG258:将736名高危子宫内膜癌患者随机分到单组化疗组与联合放化疗组,以PFS为主要终点:
·联合放化疗比单纯化疗的局部区域复发频率低。
·在延长无复发生存率方面并不优于单纯化疗。
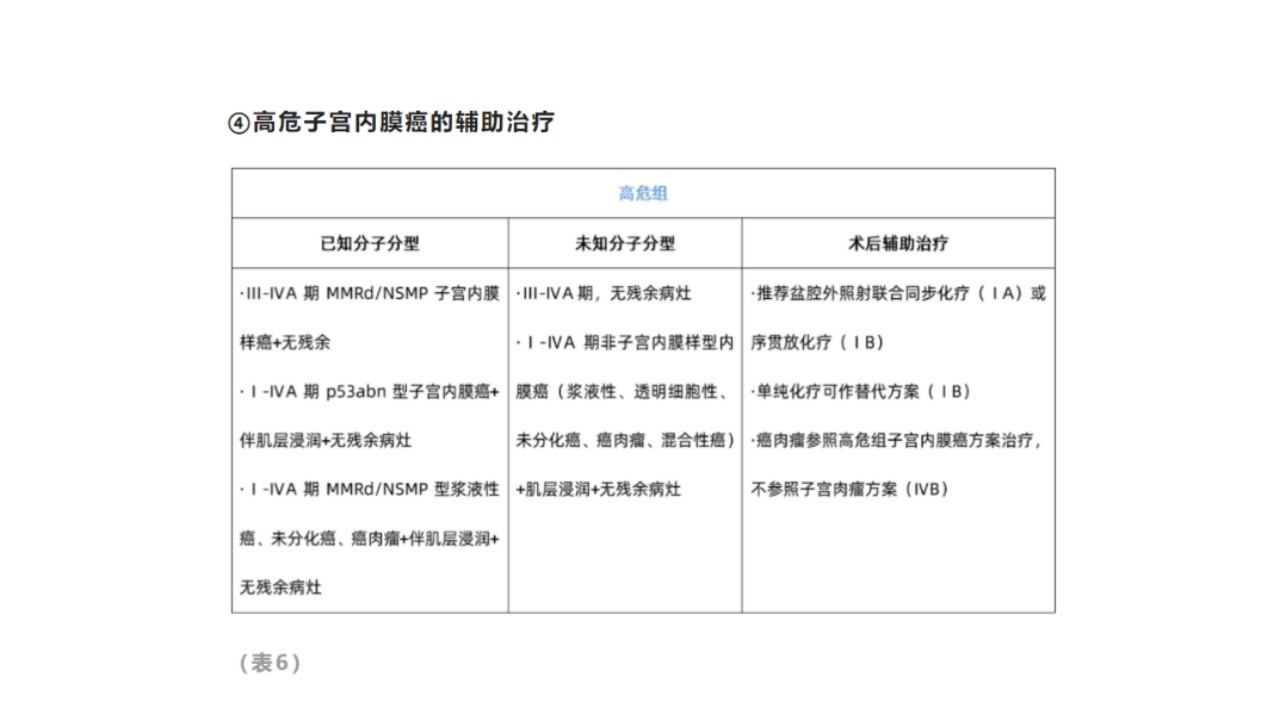
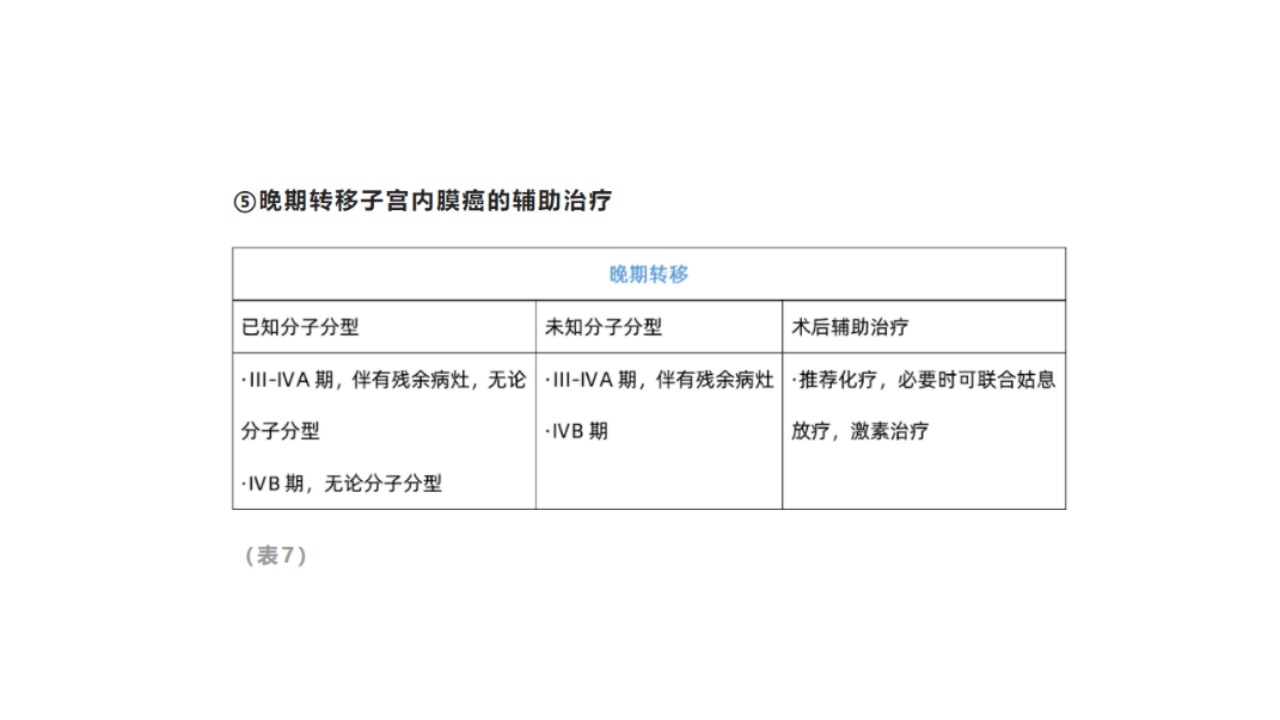
⑤晚期转移子宫内膜癌的辅助治疗
2.目前国内现状
因为分子分型没有充分开展,因此以分子分型为基础选择术后辅助治疗方案应用较少。
(六)子宫内膜癌术后放疗问题
1.放疗的发展(粗放到精准放疗)
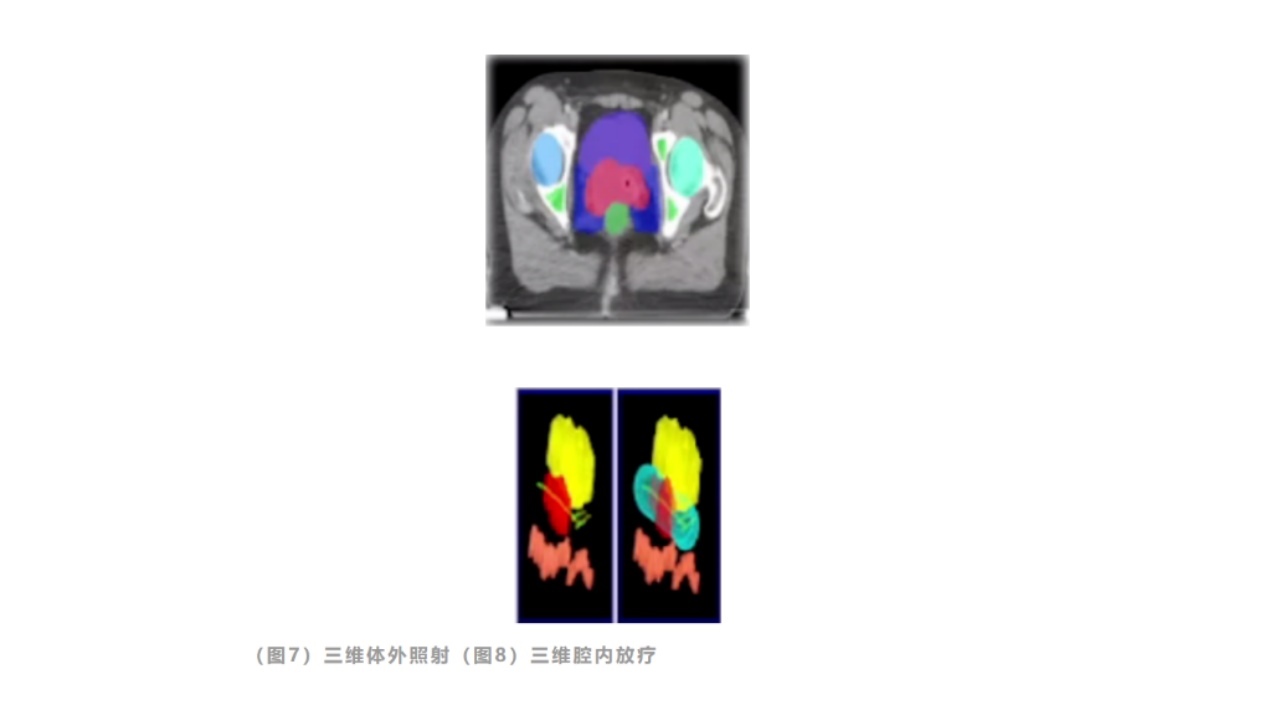
(2)三维(体积):如三维适形放疗(CRT),调强放疗(IMRT)。相较于二维,更精准,疗效更好,并发症更少。
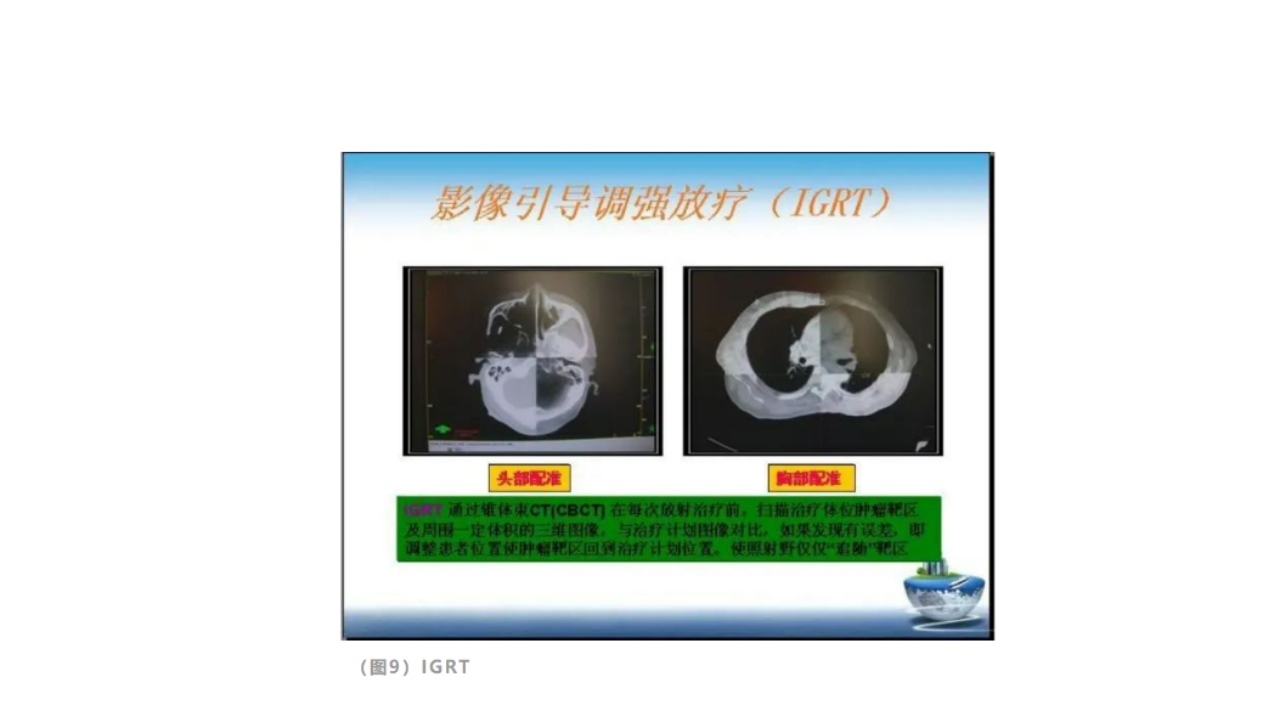
(3)四维(三维+时间):如图像引导的放射治疗(IGRT)。此种方法更精准。
2.放射治疗是子宫内膜癌治疗的主要手段之一,可分为体外照射和腔内放疗。
(1)体外照射(EBRT):主要针对肿瘤蔓延和转移区域的治疗,照射范围包括大体病灶、髂总下段、髂外区、髂内区、宫旁区、阴道上段、骶前区(宫颈侵犯时)。
①延伸野照射应包括髂总和腹主动脉旁淋巴结区域,上界至少应达到肾血管水平。
②三维适形或调强放疗是目前主要推荐的体外照射技术,尤其是调强技术,由于相关的急性和慢性毒性反应发生率低,现已广泛应用于临床。典型的照射剂量是45-50.4Gy,每次1.8-2.0Gy,疗程5-6周。治疗通常在术后4周开始,以便伤口充分愈合。
(2)腔内放疗(近距离放疗,后装放疗):主要用于阴道残端和部分阴道上段的照射。一般分3-5次完成,一周1-2次,可使用阴道卵圆形或阴道柱形施源器。
近年来,内照射逐渐进入三维、个体化治疗时代,影像引导三维近距离治疗技术在子宫内膜癌的治疗中也逐渐增多。
3.术后放疗
(1)术后体外照射:一般于术后2-4周,腹壁切口愈合后开始进行。一般行盆腔野照射;如果髂总淋巴结或腹主动脉旁淋巴结转移加行延伸野照射。盆腔野照射推荐剂量DT4000-5000cGy。每周5次,连续照射4-5周。

(2)术后腔内照射:可于体外照射同时或单独进行。因子宫已被切除,此时剂量参照点为阴道黏膜表面或黏膜下0.5cm,前者给予6Gy×5F,后者给予7Gy×3F(NCCN)。一般于术后4-6周开始,应不晚于术后12周结束。如给予体外照射,腔内治疗剂量应减少(推荐4-6Gy×2-3F)。
(七)腔内放疗为什么在内膜癌术后更常用?
1.疗效好(提高OS,减少阴道残端复发率)
2.并发症少(消化道、泌尿道)
相比较而言,宫颈癌术后仅用于阴道切缘阳性,现也用于宫颈深部间质受侵者。
3.阴道近距离放疗与盆腔外照射如何选择?

PORTEC-2:将472名患者随机分配到阴道近距离放疗组及外照射组,两组有相当的阴道及盆腔控制率,5年局部(阴道)复发率无显著差异,而阴道近距离放疗的胃肠毒性、膀胱毒性更低;此外,在现代放疗时代,近距离放疗费用远远低于体外照射。
(八)免疫治疗的应用
1.子宫内膜癌的免疫治疗——免疫检查点抑制剂(ICIs)
免疫检查点(ImmuneCheckpoint):是在免疫细胞上表达、能调节免疫激活程度的一类免疫抑制性分子,以保护正常组织细胞不受免疫细胞攻击。
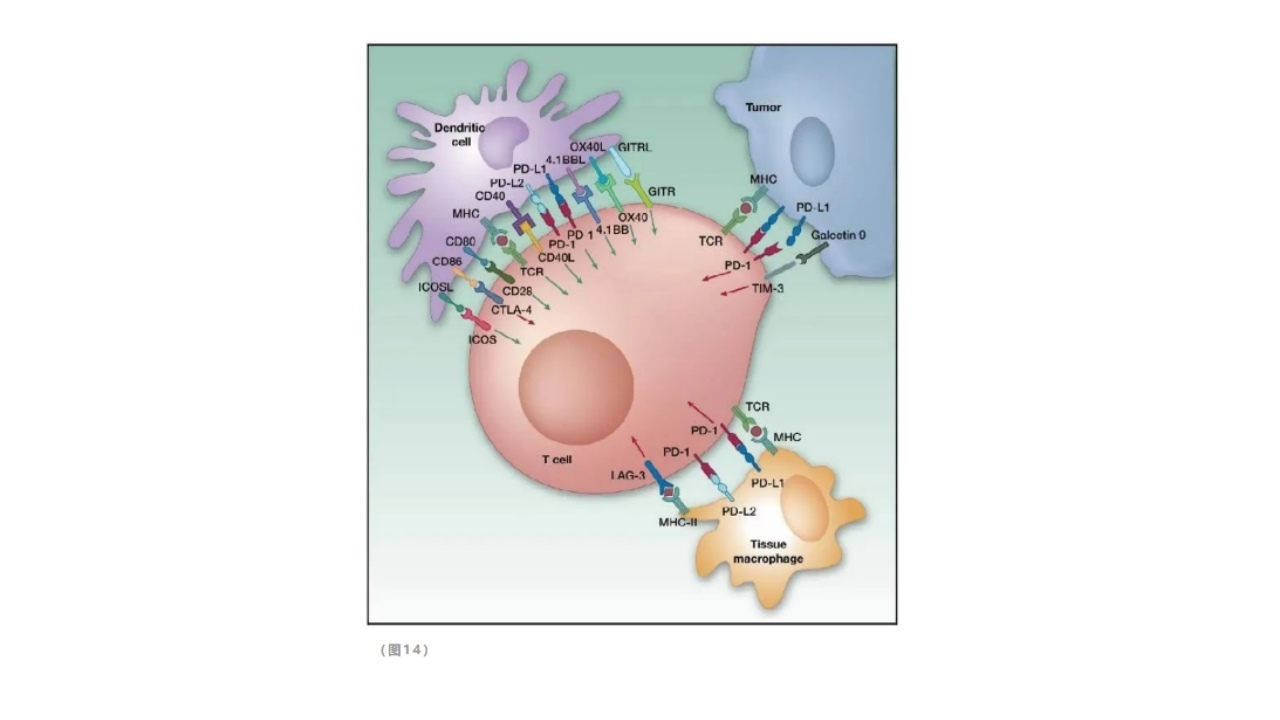
2.应用免疫检查点抑制剂进行免疫治疗的条件
(1)PD-L1阳性。
(2)肿瘤突变负荷(tumormutationburden,TMB):是指肿瘤基因组去除胚系突变后的体细胞突变数量。在多种实体瘤中已经证实了TMB与对ICIs的反应之间存在显著的正相关性,并且目前已有多项研究结果证实了TMB在免疫或联合治疗中的预测价值。2020年FDA批准TMB作为帕博利珠单抗治疗的辅助诊断生物标志物。
(3)DNA错配修复缺陷(Mismatchrepairdeficiency,dMMR)、微卫星不稳定(microsatelliteinstability,MSI)。
3.子宫内膜癌中应用的免疫检查点抑制剂(ICIs)
(1)PD-1抗体:纳武利尤单抗(nivolumab)、卡瑞利珠单抗(camrelizumab)、西米普利单抗(cemiplimab)、巴替利单抗(balstilimab)。
(2)PD-L1抗体:帕博利珠单抗(pembrolizumab)、阿特珠单抗(atezolizumab)、度伐鲁单抗(durvalumab)。
(3)MMRd子宫内膜癌已被证明具有强烈的CD8+免疫浸润,并且在最初的研究中发现,抑制某些检查点分子(例如PD-1和PD-L1)对转移性MMRd子宫内膜癌具有治疗效果,有效率约为43%。
(九)靶向治疗的应用
1.有研究发现在非子宫内膜样癌或p53abn癌组中,高达50%的患者存在同源重组缺陷,这表明多腺苷二磷酸核糖聚合酶[poly(ADP-ribose)polymerase,PARP]抑制剂可能具有潜在作用。关于PARP抑制剂在子宫内膜癌中的应用,目前尚处于实验阶段。
2.对于Ⅲ期/Ⅳ期或复发的HER-2阳性子宫浆液性腺癌,NCCN推荐,可选择化疗与靶向药(曲妥珠单抗)联合,晚期及复发病例可选择卡铂+紫杉醇+贝伐单抗联合。
3.将仑伐替尼(多靶点的激酶抑制剂,如VEGFR-1,2,3等)+帕博利珠单抗(K药)这一方案作为1级证据,推荐用于不存在MSI-H或MMRd,没有手术或放疗治愈的可能性,并且在既往系统治疗后进展的患者。而NTRK基因融合阳性的患者,可用拉罗替尼或恩曲替尼。

(十)内分泌治疗的应用

*激素治疗:可用于内膜癌保守治疗或者晚期复发患者,不推荐用于早期内膜癌术后患者。
三苯氧胺可诱导雌激素、孕激素形成,提高疗效。
总结
总之,子宫内膜癌术后辅助治疗方案的选择,虽然还缺少较多的多中心前瞻性研究,来提供循证医学证据,但是其选择渐趋个体化,特别是分子分型越来越多地用于临床。

[声明:本网站所有内容,凡未注明来源为“转载”,版权均归巢内网所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:巢内网”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们]

