
睡眠有道|天津医科大学总医院神经内科睡眠系列大讲堂

薛蓉 神经内科·主任医师
天津医科大学总医院
一、睡眠障碍国际分类
2014年美国睡眠医学会发布的第3版国际睡眠障碍分类(InternationalClassificationofSleepDisorders,ICSD),将睡眠障碍分为了以下几种,包括失眠障碍、睡眠相关呼吸障碍、中枢性过度嗜睡障碍、睡眠-觉醒昼夜节律障碍、异态睡眠、运动相关睡眠障碍、其他睡眠障碍。这些普遍存在的睡眠障碍会对患者造成巨大的身体和心理压力。
1.失眠障碍在临床中十分常见,常伴有焦虑、抑郁与精神障碍;
2.睡眠相关呼吸障碍在临床中逐渐得到关注,包括中枢性及阻塞性睡眠呼吸暂停(obstructivesleepapnea,OSA)两类;
3.中枢性过度嗜睡障碍(发作性睡病),近年多发,逐渐被睡眠学专家关注,发作性睡病是一种自身免疫性疾病,在临床中常被误诊;
4.睡眠-觉醒昼夜节律障碍于2017年被JeffreyC.Hall,MichaelRosbash和MichaelW.Young发现昼夜节律的分子机制,授予诺贝尔生理学奖,人体中枢生物钟对调节昼夜节律以及外周脏器节律十分重要,长期节律障碍可引起各器官疾病的发生,昼夜节律与睡眠直接相关;
5.异态睡眠主要包括睡眠期行为功能障碍、精神疾病性睡眠障碍等,也可能是神经变性病的窗口,引起相关神经系统疾病的发生;
6.运动相关睡眠障碍包括不宁腿综合征、睡眠周期性肢体活动等,在临床多发,日间功能有时受损,同时高血压、不宁腿综合征伴焦虑障碍也越来越得到临床医生的重视,“早发现、早诊治”可获得良好预后;
7.其他睡眠障碍包括短睡者、高原反应失眠等,这些都为不太常见的疾病。
神经科医生应该对以上七种睡眠障碍分类以及90多种疾病有深刻认识和理解,并做到规范诊治。
二、睡眠障碍对躯体疾病的影响
相关研究表明,睡眠障碍对偏头痛、脑血管病、癫痫、认知障碍(阿尔茨海默病AD)、突触核蛋白病(包括帕金森PD、多系统萎缩MSA、路易体痴呆DLB)、自身免疫性疾病等具有较大影响。睡眠障碍存在着神经系统疾病的前驱期,也可以称为核心症状或者是疾病愈后转归,是非常重要的因素。
因此,睡眠障碍对神经系统疾病的影响非常重要,对睡眠障碍进行早期干预,对预后转归也十分重要。
例如,脑血管病常伴随运动相关的睡眠障碍,包括不宁腿综合征、睡眠周期性肢体活动,与癫痫、OSA、失眠、嗜睡等都有关系。
1.睡眠障碍对脑血管病的影响
失眠可能与脑血管疾病有关。2017年的相关研究指出,睡眠减少和睡眠节律紊乱可影响基因的多态性,但失眠剥夺后会引起慢波睡眠减少,引起神经细胞的能量代谢变化,甚至引起交感神经兴奋,这种情况下,可能引起Orexin分泌的增多或者血压的不稳定性,HPA轴上调,胰岛素抵抗,炎性细胞因子TNFα对胰淀素表达的上调作用,免疫炎性介质途径的增加,导致糖尿病的发生以及高血压的风险。
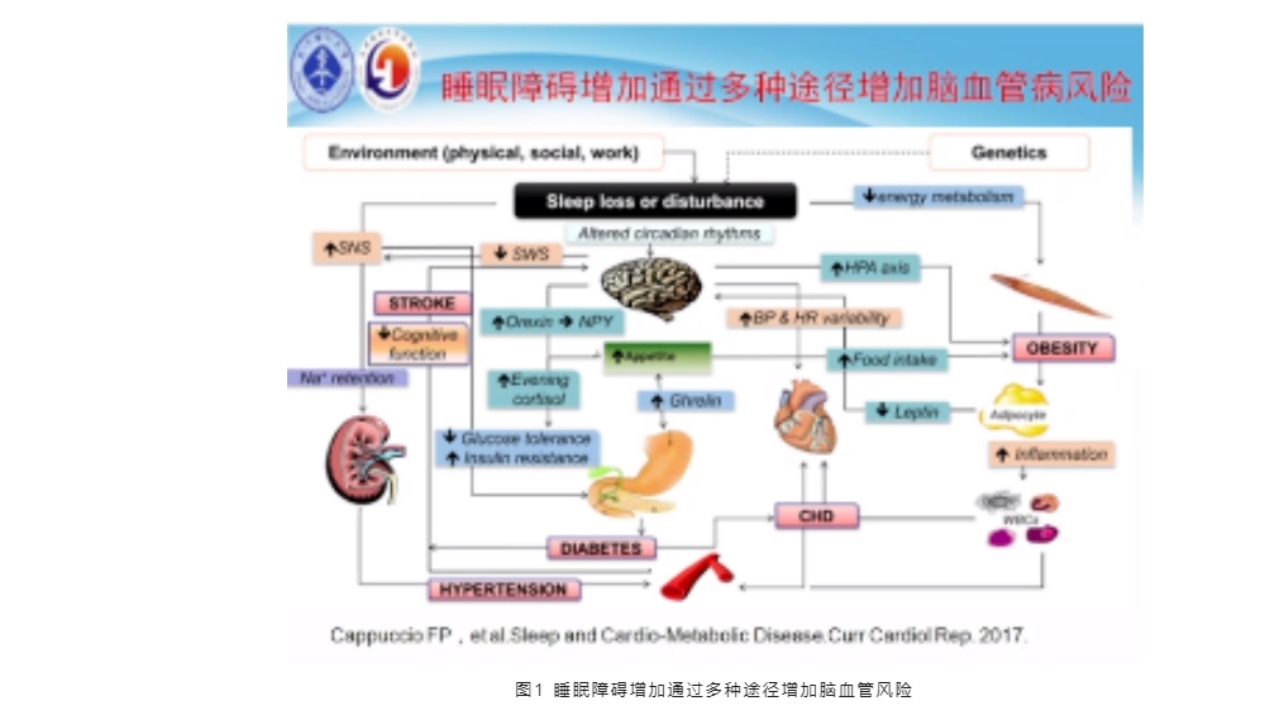
2.失眠对卒中的影响
(1)失眠者发生卒中的风险增加
一项4年的随访研究显示,失眠者发生卒中的风险比非失眠者增高54%,持续存在失眠的患者,卒中的3年累积发病率高于可缓解的失眠患者。
另外一项文献,63257例(年龄45-74)中国成年人的随访研究中显示,过多或过少的睡眠持续时间,均增加中国人群的卒中(除外出血性卒中)死亡风险,尤其是在有高血压病史的人群中。
另外,还有文献报道,4467例18-55岁的缺血性卒中或TIA患者中,睡眠持续时间较短者占20.6%,是缺血性卒中或TIA的潜在危险因素。
(2)睡眠障碍导致卒中预后不良,死亡率更高
一项纳入21438名失眠患者和64314名非失眠患者,长达四年的回顾性队列研究中,采用国际医学操作分类(第九次修订)ICD-9-CM定义失眠及卒中,并排除睡眠呼吸暂停患者,所有试验者试验开始前均未被诊断为卒中、睡眠呼吸暂停和失眠,主要结局指标为第一次卒中急性发作入院治疗。
结果显示:失眠患者中发生卒中风险比非失眠患者高54%(IRR等于1.85;矫正风险比HR等于1.54;95%CI1.38-1.72)。与睡眠正常组比较,失眠患者中18到34岁组的卒中患病风险最高(IRR等于8.06)。

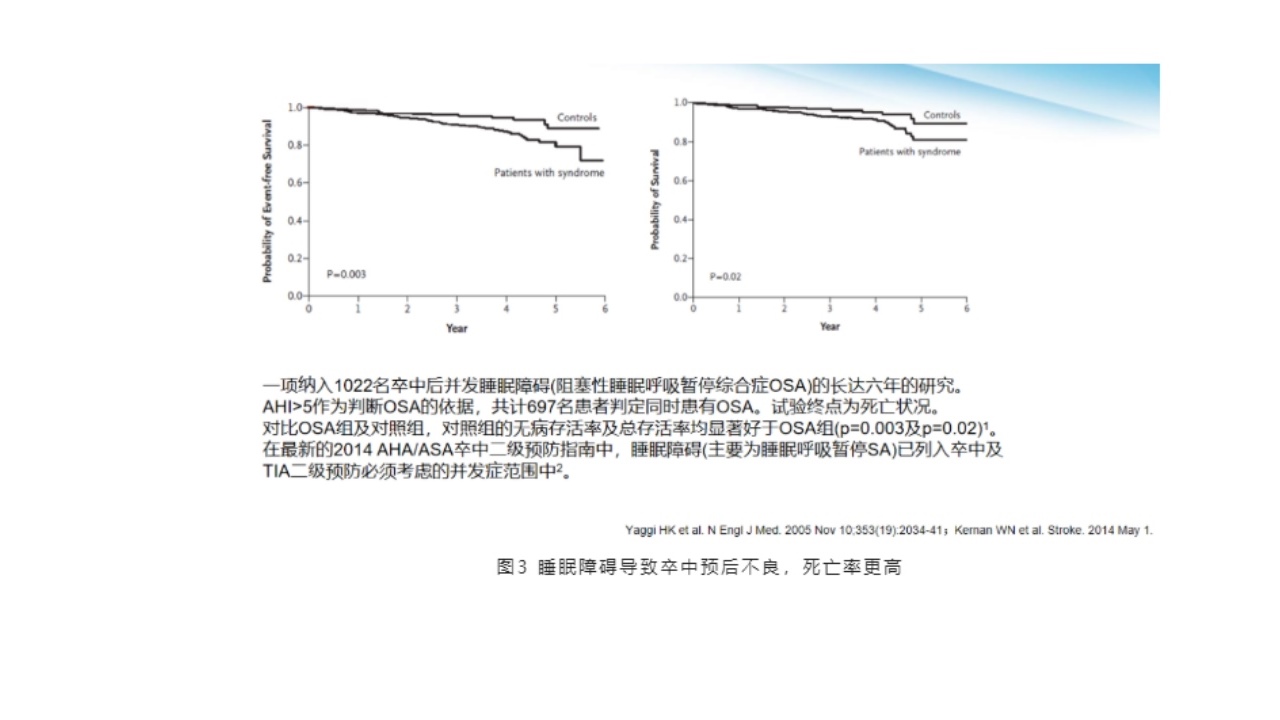
一项纳入1022名卒中后并发睡眠障碍(阻塞性睡眠呼吸暂停综合症OSA)长达六年的研究中,AHI大于5作为判断OSA的依据,共计697名患者判定同时患有OSA。试验终点为死亡状况。
对比OSA组及对照组,对照组的无病存活率及总存活率均显著好于OSA组(p等于0.003及p等于0.02)。在最新的2014AHA/ASA卒中二级预防指南中,睡眠障碍(主要为睡眠呼吸暂停SA)已列入卒中及TIA二级预防必须考虑的并发症范围中。
提示:睡眠障碍可能会导致卒中预后不良和死亡增加。
(3)失眠影响卒中康复期健康相关生活质量
一项研究表明,卒中后3个月,失眠组精力、思维领域受损,整体健康生活相关生活质量较非失眠组降低。

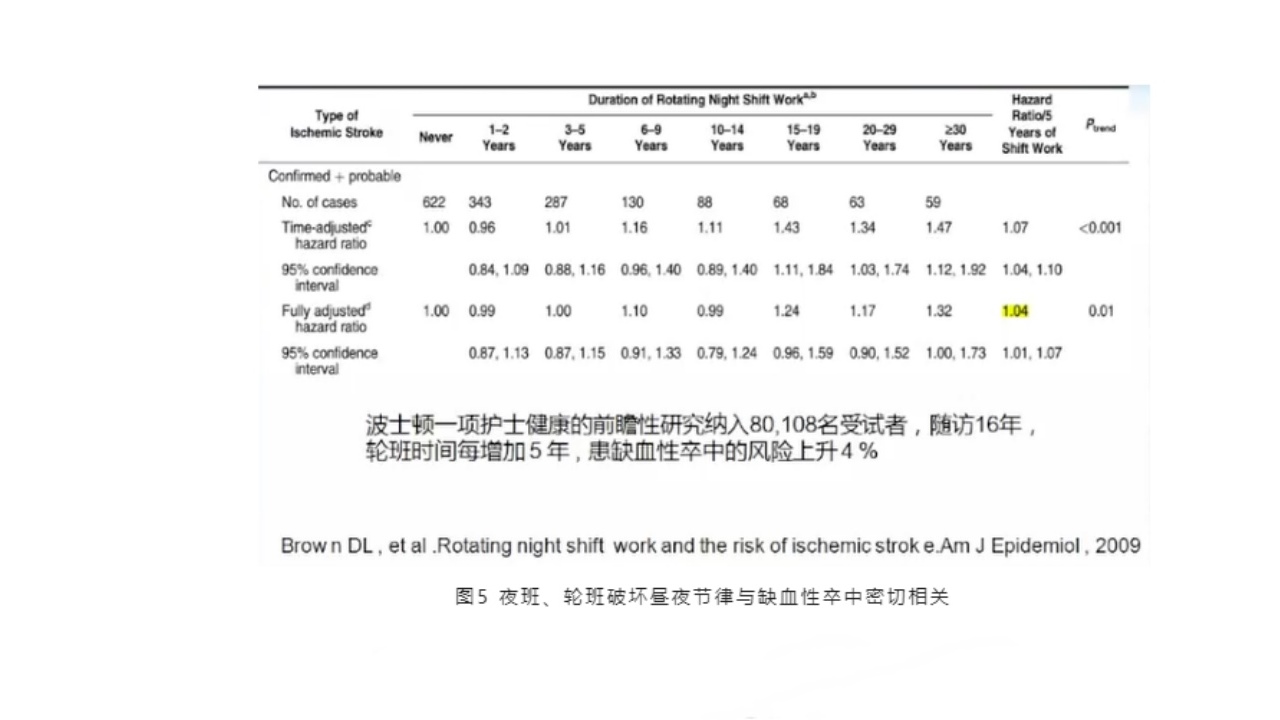
(4)夜班、轮班破坏昼夜节律与缺血性卒中密切相关
夜班、倒班、轮班都破坏了昼夜节律,与缺血性卒中密切相关。有关波士顿的一项护士健康前瞻性研究,纳入了80108名受试者,随访16年,轮班时间每增加5年,患缺血性卒中的风险上升4%。
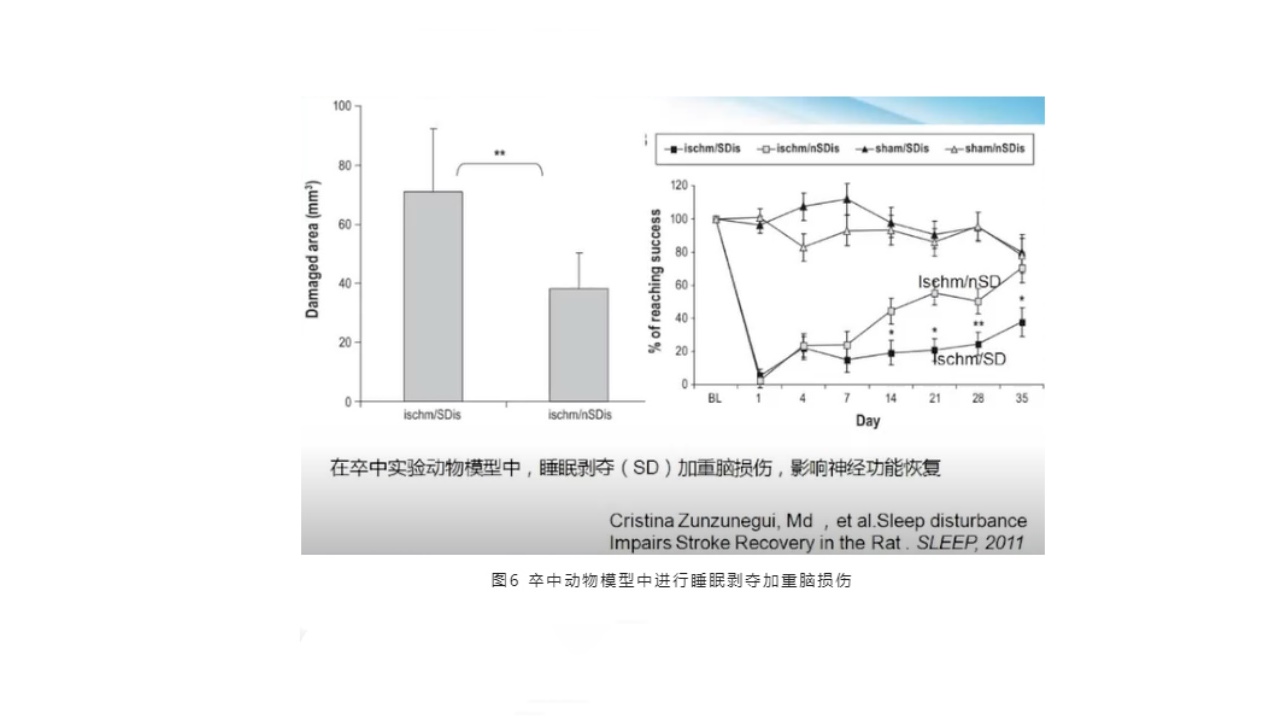
在一项卒中实验动物模型中,睡眠剥夺(SD)会加重脑损伤,影响神经功能恢复。
(5)自然光或利于卒中住院患者恢复
昼夜节律紊乱在年轻人的日常生活当中也是非常常见的,比如夜里三点睡觉,中午12点起床,这就是节律障碍。
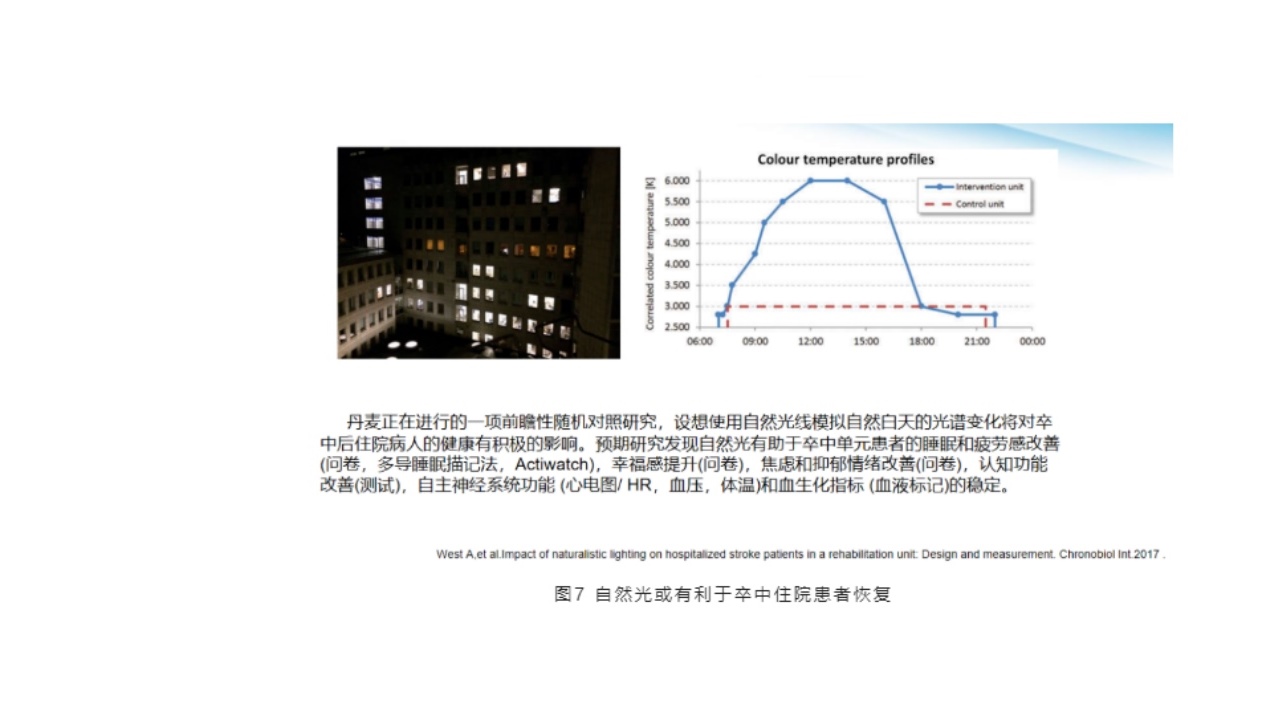
此项研究是丹麦正在进行的一项前瞻性随机对照研究,设想使用自然光线模拟自然白天的光谱变化将对卒中后住院病人的健康有积极的影响。预期研究发现自然光有助于卒中单元患者的睡眠和疲劳感改善(问卷、多导睡眠描记法,Actiwatch),幸福感提升(问卷),焦虑和抑郁情绪改善(问卷),认知功能改善(测试),自主神经系统功能(心电图/HR,血压,体温)和血生化指标(血液标记)的稳定。
(6)慢性失眠患者的脑血流调节功能
2017年在中华神经科学杂志上王赞等人发表的研究表明:使用无创动态脑血流自动调节检测技术检测失眠患者的脑血流调节功能结果显示,伴有广泛焦虑的慢性患者的动态脑血流自动调节功能受损,但受损的严重程度与焦虑、抑郁的严重程度无线性相关。
(7)健康成年人急性睡眠剥夺后局部脑血流下降
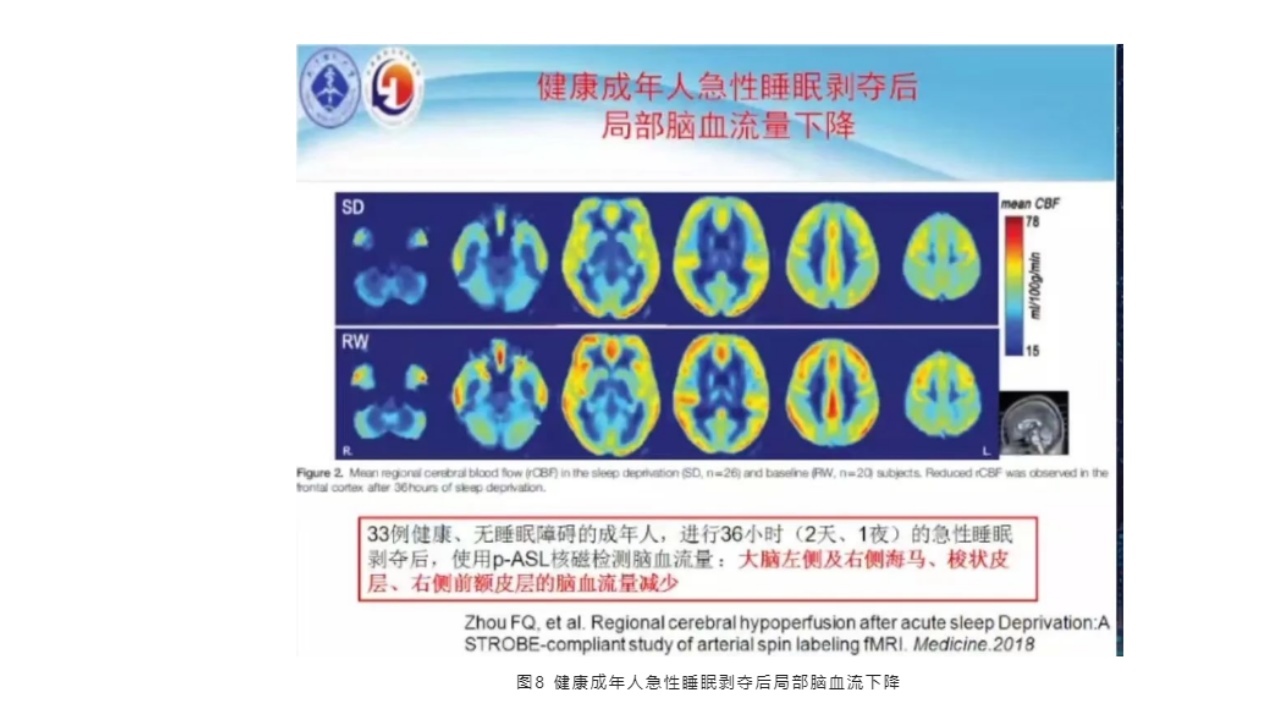
此文献于2018年Magazine发表,33例健康、无睡眠障碍的成年人,进行36小时(2天、1夜)的急性睡眠剥夺后,使用p-ASL核磁检测脑血流量:大脑左侧及右侧海马、梭状皮层、右侧前额皮层的脑血流量减少。
去年我们的睡眠团队也做出了相应的结果,也就是说慢性失眠患者的脑血流ASL在大脑皮层、额颞叶,以及海马出现了明显的下降,也就解释了所谓慢性失眠患者为什么会出现认知功能障碍和情绪障碍。所以,临床上经常在慢性失眠患者身上使用银杏叶等药物改善血流调节状态。
3.睡眠呼吸暂停综合征与脑卒中
(1)OSA影响脑卒中发生与转归的主要机制
OSA影响卒中发生与转归的机制是复杂的、多重的,OSA可以经由自主神经的变化、血流动力学异常、凝血机制改变和血管内皮细胞损伤直接影响到脑血管,引发脑卒中,也可因其引发、加重脑卒中的危险因素,如高血压、高血脂、糖代谢紊乱、心脏疾病等,而间接地影响脑卒中发生与转归。
在美国耶鲁大学医学院睡眠医学中心YaggiH等研究中显示,1022例患者中,有697例(68%)存在OSAS,校正年龄、性别、种族、吸烟、饮酒、体重指数及是否患有糖尿病、血脂异常、心房颤动及高血压等基础疾病因素的影响后,OSA仍然与脑卒中显著相关,且OSAS越重,发生脑卒中的危险度也越高;2005年ArztM等进行的长期、前瞻性系列研究中也证实OSAS是脑卒中的独立危险因素;TurkingtonPM等研究发现脑卒中患者上呼吸道梗阻的程度愈严重,则其预后的功能恢复愈差,并可能会增加脑卒中患者的病死率,认为上呼吸道梗阻的治疗可能会改善脑卒中患者的预后;Martinez-GarciaMA等对166例缺血性脑卒中合并睡眠呼吸暂停的患者进行了5年的追踪调查,结果显示缺血性脑卒中合并OSAS的患者的死亡率明显增加,并且使用CPAP治疗后,能够降低这些患者的死亡风险。
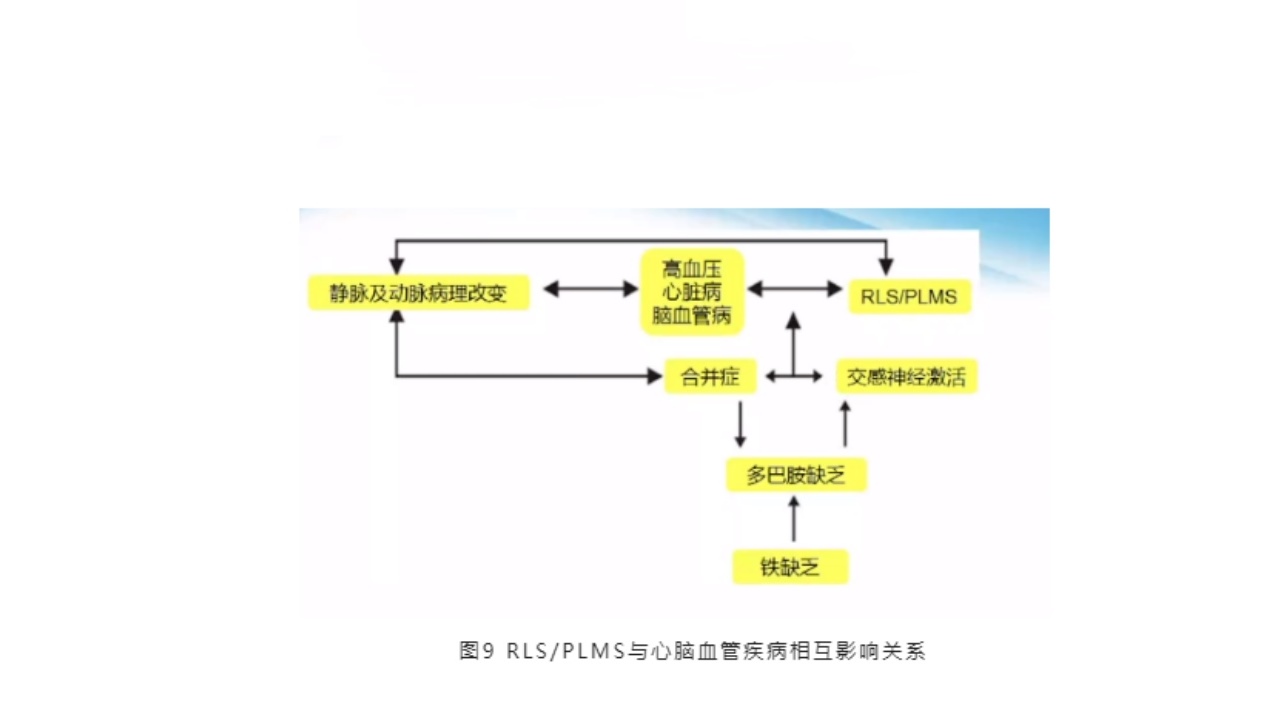
4.RLS/PLMS与心脑血管疾病相互影响
在脑卒中心脑血管病中,不宁腿综合征、睡眠周期性肢体活动同样会引起夜间睡眠的片段化、交感神经兴奋,甚至引起日间的高血压、心脏病以及脑血管病。2009年有研究报道,心脑血管病患者的夜间睡眠质量,以及夜间不宁腿综合征、睡眠周期性肢体活动等睡眠运动是重要的筛查指标。

此文献是基于300万例美国退伍军人前瞻性研究(男性93%,平均随访时间8.1年)显示,与无RLS症状相比,RLS患者的死亡风险高88%,发生冠心病及卒中风险近为四倍,死亡风险增加88%。因此,临床中患者夜间是否有睡眠相关的运动障碍值得我们的关注。
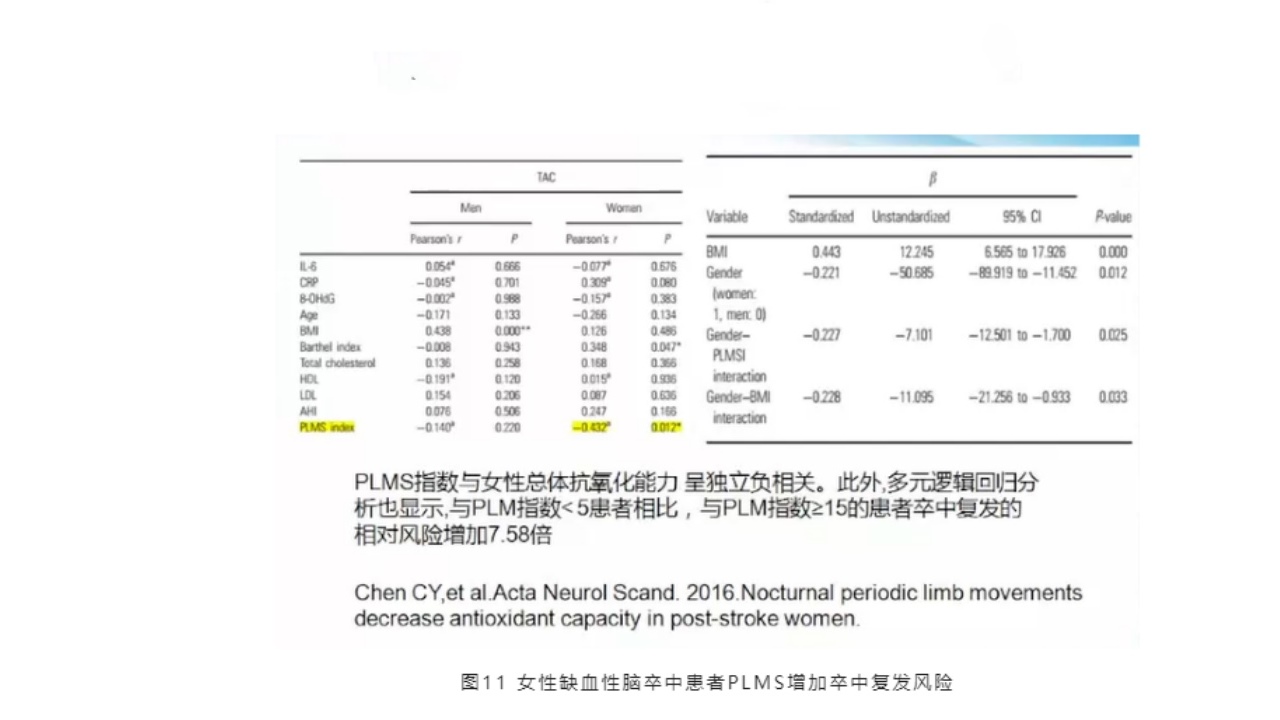
另外,还包括女性的缺血性卒中,其睡眠周期性肢体活动确实增加了卒中的风险。有文献报道,女性缺血性卒中患者PLMS会增加卒中复发的风险,PLMS指数与女性总体抗氧化能力呈独立负相关。此外,多元逻辑回归分析也显示,与PLM指数小于5的患者相比,与PLM指数大于等于15的患者,卒中复发的相对风险增加7.58倍。
5.睡眠与癫痫相互影响
(1)睡眠对癫痫的影响
癫痫是神经科常见的疾病,癫痫与睡眠障碍相互影响,睡眠结构破坏,噩梦、睡眠片段化、嗜睡、失眠和觉醒后疲倦与异态睡眠,会增加癫痫的发生,癫痫发作频率,以及症状的恶化,而癫痫又增加了夜间的睡眠障碍。
当前,很多癫痫猝死病例被报道,患者既往经常出现癫痫相关的呼吸暂停和发作后呼吸抑制,推测睡眠障碍可能是其诱因,或与低通气和心律失常有关。此外,癫痫患者睡眠质量差与自杀观念产生有关,即癫痫的睡眠质量与抑郁是直接相关的。
研究表明,存在睡眠障碍的患者比正常人群癫痫的患病率明显增高。癫痫发生最常见的病人是OSA,尤其是失眠共OSA是引起癫痫非常常见的症状。OSA可引起低氧血症,引发未成熟的海马过度兴奋,神经元兴奋增加;而REM睡眠减少,睡眠片段化/睡眠剥夺,同样会引起神经元兴奋增加,引发癫痫发作/加重癫痫。临床中,发现共病OSA的癫痫患者,使用CPAP治疗后,可以明显减少癫痫发作的频率;失眠症合并癫痫的患者给予褪黑素治疗后,癫痫发作频率也减少了,这是非常重要的治疗途径。
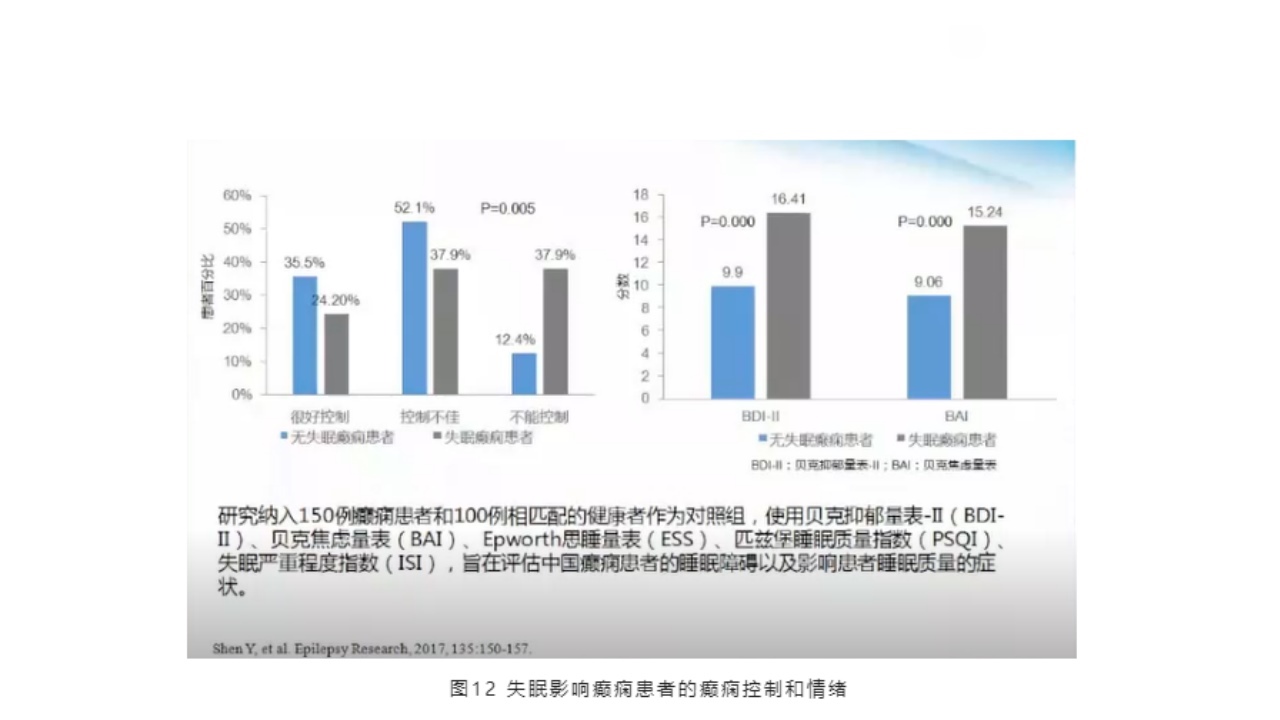
此文献表明,失眠影响癫痫患者对癫痫的控制和情绪。一项研究纳入150例癫痫患者和100例相匹配的健康者作为对照组,使用贝克抑郁量表-II(BDI-II)、贝克焦虑量表(BAI)、Epworth思睡量表(ESS)、匹兹堡睡眠质量指数(PSQI)、失眠严重程度指数(ISI),旨在评估中国癫痫患者的睡眠障碍以及影响患者睡眠质量的症状。
(2)癫痫对睡眠的影响
癫痫患者PSG监测的特点为浅睡期(NREM睡眠1,2期)所占时间比例延长;深睡期(NREM睡眠3期)和REM期时间均缩短,REM睡眠潜伏期延长。癫痫患者睡眠特点为夜间觉醒时间增加,总睡眠时间减少,睡眠效率降低,睡眠周期转换频率明显增加,睡眠片段现象,睡眠纺锤波密度减少。癫痫对睡眠的影响可能的机制为癫痫样放电引起患者睡眠结构的改变,甚至导致患者直接觉醒。在NREM睡眠II期,正常的脑电图表现为对称纺锤波,是维护睡眠稳定性,抑制EDs的重要因素;癫痫患者弥漫性皮质神经细胞过度活动导致丘脑产生强烈的应答现象,进而影响患者的睡眠结构。在REM睡眠期,由于脑电同步化受到抑制,故较少出现EDs,对该期睡眠影响较小。
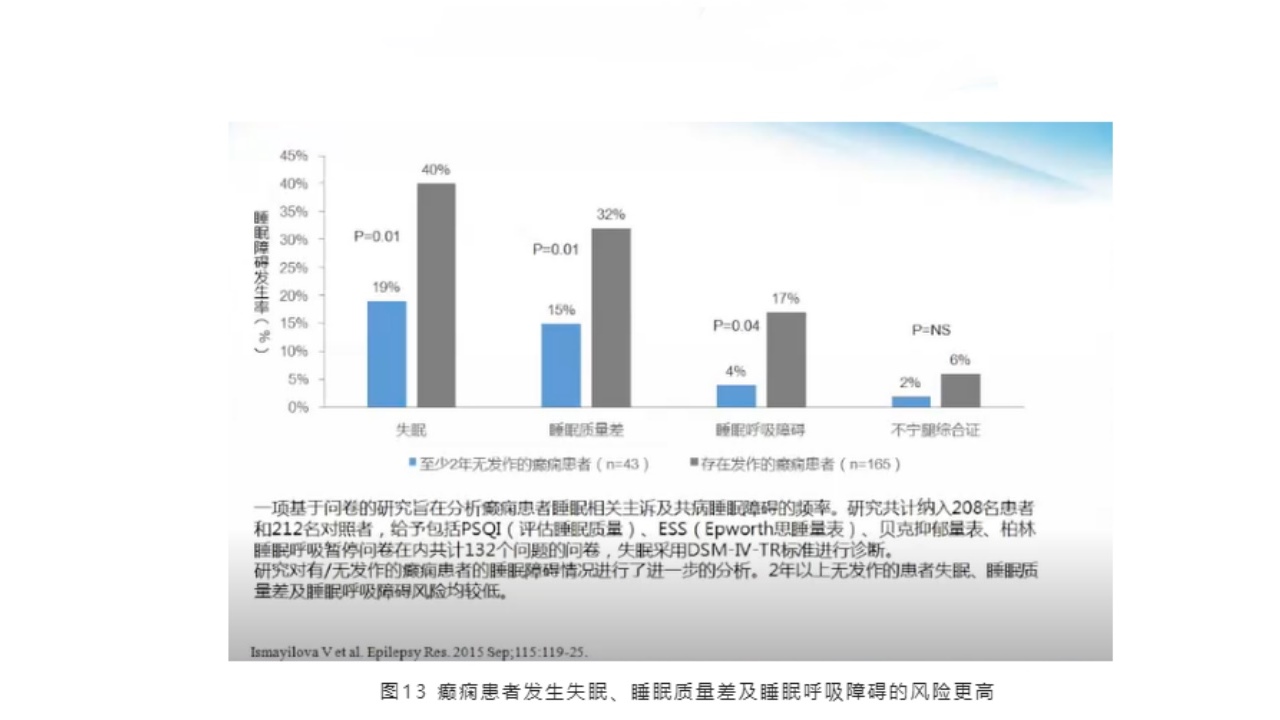
相关研究表明,癫痫患者发生失眠、睡眠质量差及睡眠呼吸障碍的风险更高。一项基于问卷的研究旨在分析癫痫患者睡眠相关主诉及共病睡眠障碍的频率。研究共计纳入208名患者和212名对照者,给予包括PSQI(评估睡眠质量)、ESS(Epworth思睡量表)、贝克抑郁量表、柏林睡眠呼吸暂停问卷在内共计132个问题的问卷,失眠采用DSM-IV-TR标准进行诊断。
研究对有/无发作的癫痫患者的睡眠障碍情况进行了进一步分析。2年以上无发作的患者失眠、睡眠质量差及睡眠呼吸障碍风险均较低。
(3)异态睡眠与夜间发作的癫痫
NREM异态睡眠通常发生在夜间前1/3时间段的NREM深睡眠阶段;REM异态睡眠(如梦魇、睡眠瘫痪及REM睡眠行为障碍)则往往发生于夜间后1/3的REM睡眠期;夜间癫痫发作常见于刚入睡时的NREM期或从睡眠中觉醒时VEEG和PSG,则可进一步明显诊断。研究表明,夜间的癫痫发作往往是刻板性的,明显持续的时间为数分钟,且频率不一定。
(4)抗癫痫药与睡眠的影响
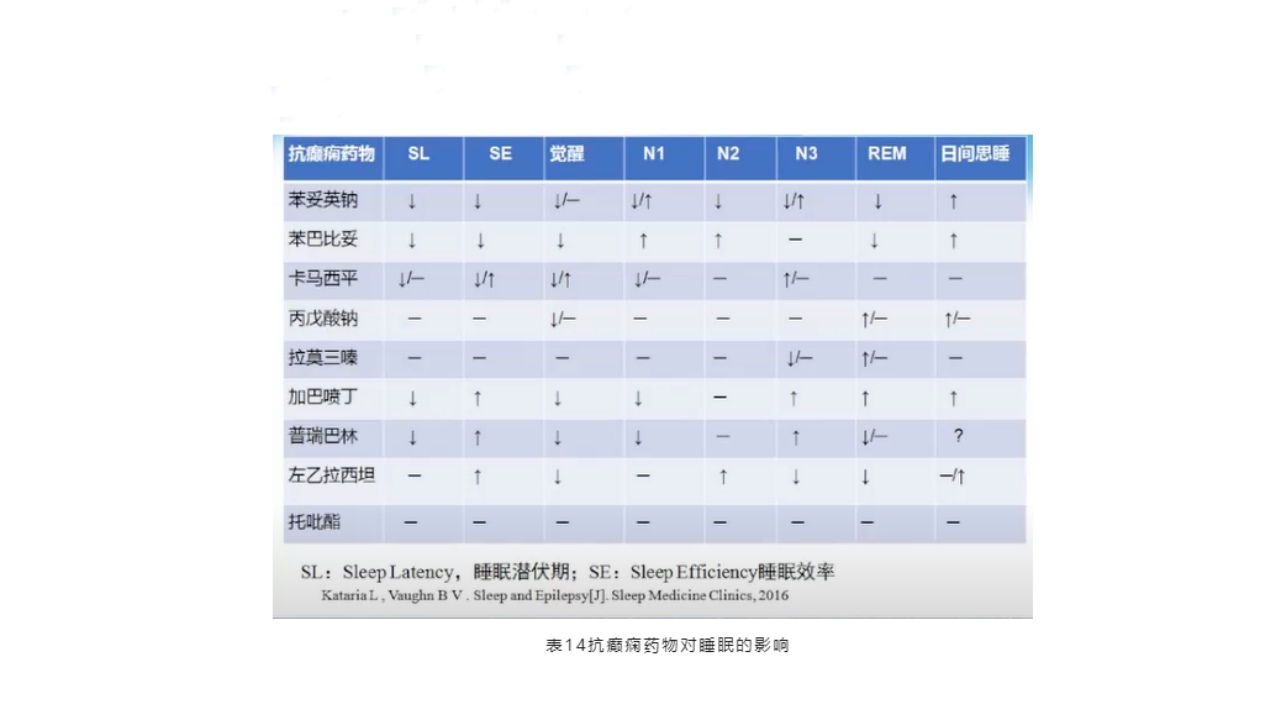
抗癫药会引起睡眠障碍,所以神经科医生在临床用药时,需要考虑药物对睡眠的影响。研究表明,拉莫三嗪以及托吡酯有较少的睡眠障碍影响。
6.睡眠障碍对认知功能的影响
睡眠剥夺以及昼夜节律障碍可明显影响多项认知功能,比如减慢反应时间、增加持续言语症状、减少注意力、降低语言及沟通能力、减少发散思维、损伤风险评估和策略制定。
(1)睡眠的剥夺导致认知功能障碍的机制
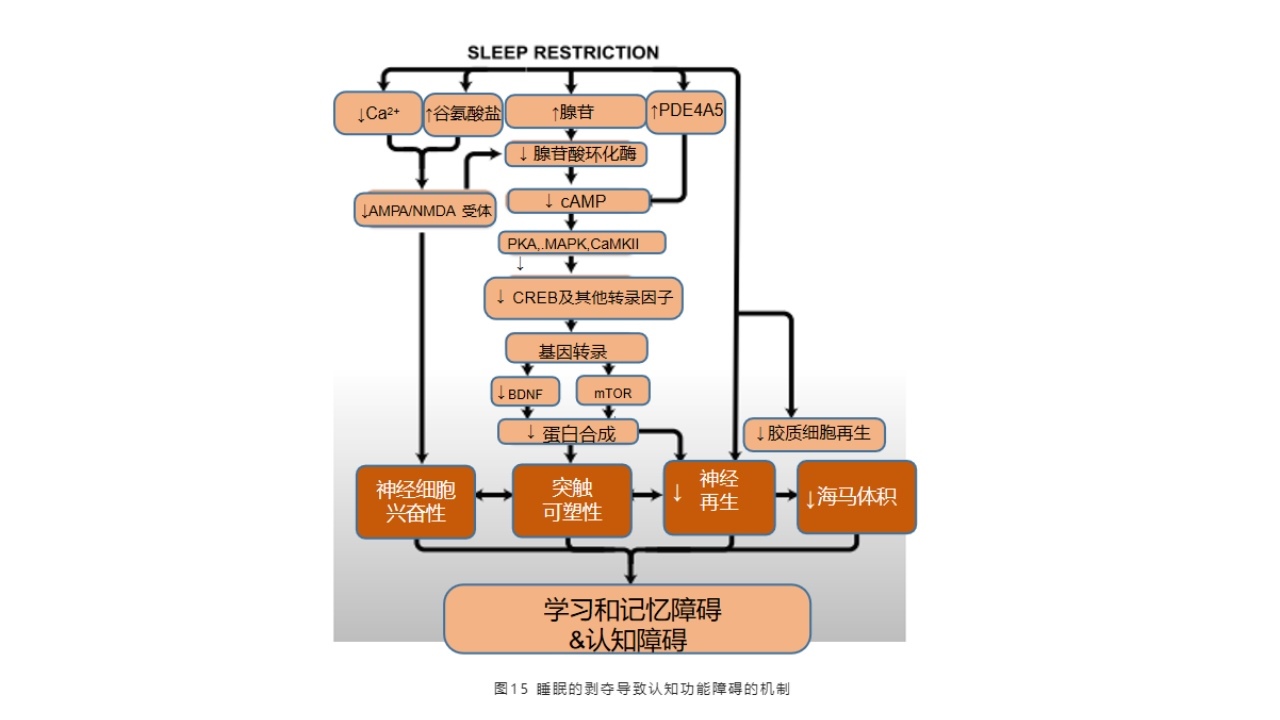
2015年文献报道,睡眠的限制以及睡眠的剥夺导致认知功能障碍的机制非常明确,尤其在基础研究当中,做了BDF、基因转录、神经细胞兴奋性、突触的可塑性、神经再生,以及胶质细胞再生,海马体积的变化,都证实了睡眠障碍导致的认知功能障碍的脑损伤的途径。
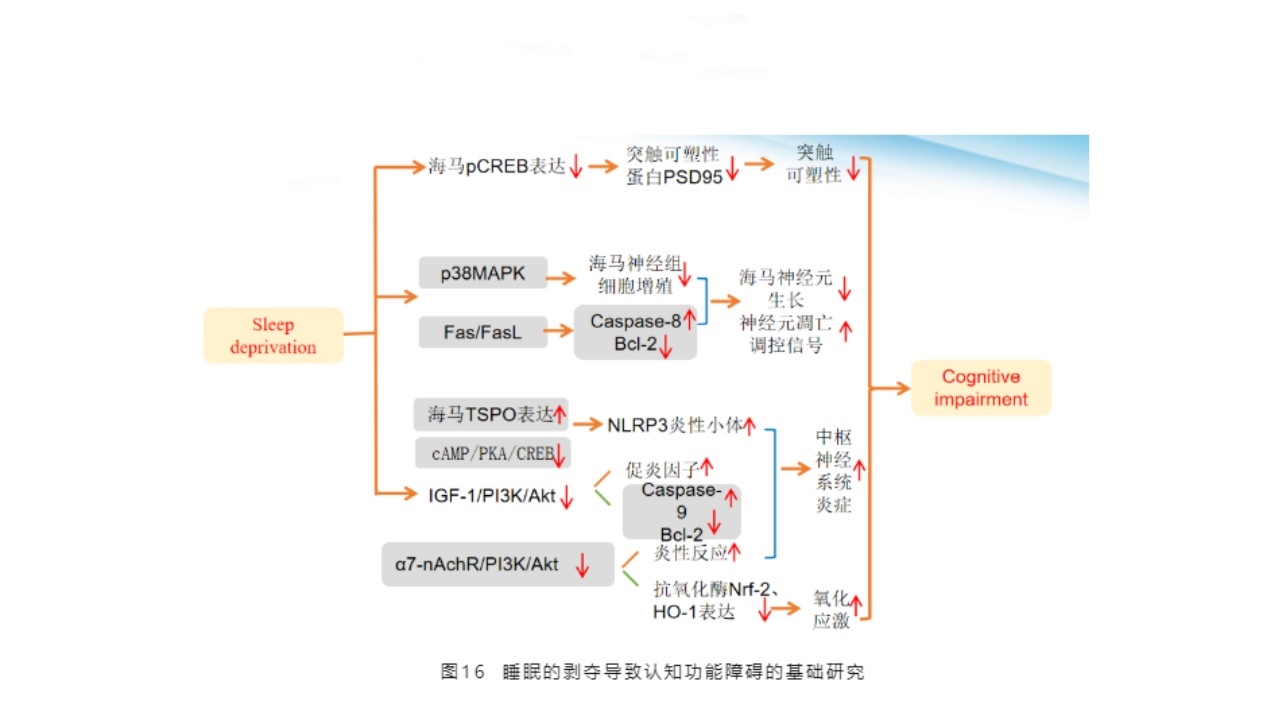
近年来,天津医科大学总医院神经内科睡眠团队关于IL-17/p38MAPK通路在小鼠REM睡眠剥夺后,海马神经祖细胞增殖的作用机制研究得出以下结论:睡眠剥夺促使海马组织IL-17基因及蛋白水平的增加,激活p38MAPK通路,可能直接抑制海马齿状回神经祖细胞的增殖,也可能进一步影响周围炎性环境,增强其他促炎因子的作用,从而间接抑制海马齿状回神经祖细胞的增殖。
α7-nAChR/PI3K/AKT通路在小鼠慢性睡眠剥夺的炎性作用机制研究中,得出结论:慢性睡眠剥夺抑制海马组织胶质细胞α7-nAChR表达,抑制胶质细胞α7-nAChR/PI3K/AKT/GSK-3β信号传导通路,进而抑制小鼠海马组织抗氧化酶表达,促进炎性细胞因子释放,减少抑炎细胞因子的释放,产生炎性损伤。
pCREB在小鼠REM睡眠剥夺模型中,对海马PSD-95及炎性因子影响的研究中得出睡眠剥夺抑制小鼠海马突触可塑性相关蛋白PSD-95的表达,增强小鼠海马IL-17A、TNF-α、IL-1β三种致炎因子的表达;pCREB在REM睡眠剥夺过程中对小鼠海马PSD-95及炎性因子的表达有调控作用。
REM睡眠剥夺对小鼠海马IL-21介导的炎症反应及FasFasL介导的神经元凋亡影响的研究得出结论:睡眠剥夺可能会通过增加小鼠海马炎性因子IL-21的表达,促进中枢的炎性损伤;或可能通过激活小鼠海马中Fas/FasL介导的死亡受体通路,造成凋亡诱导因子表达上调,参与调控小鼠与海马神经元的凋亡。睡眠剥夺后炎性因子IL-24可能通过影响凋亡调控因子Fas/FaslBcl-2、Caspase-8等的表达而调控海马神经元的细胞凋亡。睡眠剥夺与小鼠海马区BDNF,NGF及其受体表达的关系及淀粉样蛋白合成的影响。睡眠剥夺后,小鼠海马神经营养因子及IL-4动态变化及相关性的研究。
在睡眠剥夺过程中,小鼠海马中IL-4与BONF的表达具有强的正相关性,短时间(24h)睡眠剥夺可能增加小鼠海马中BDNF、IL-4的含量,提示短时间的睡眠剥夺对机体是一种刺激,随着睡眠剥夺时间的延长,睡眠剥夺48h时小鼠海马中BDNF、IL-4表达量降至对照组基线水平。
(2)生物钟振荡器与记忆的相互作用(同步化与去同步化)
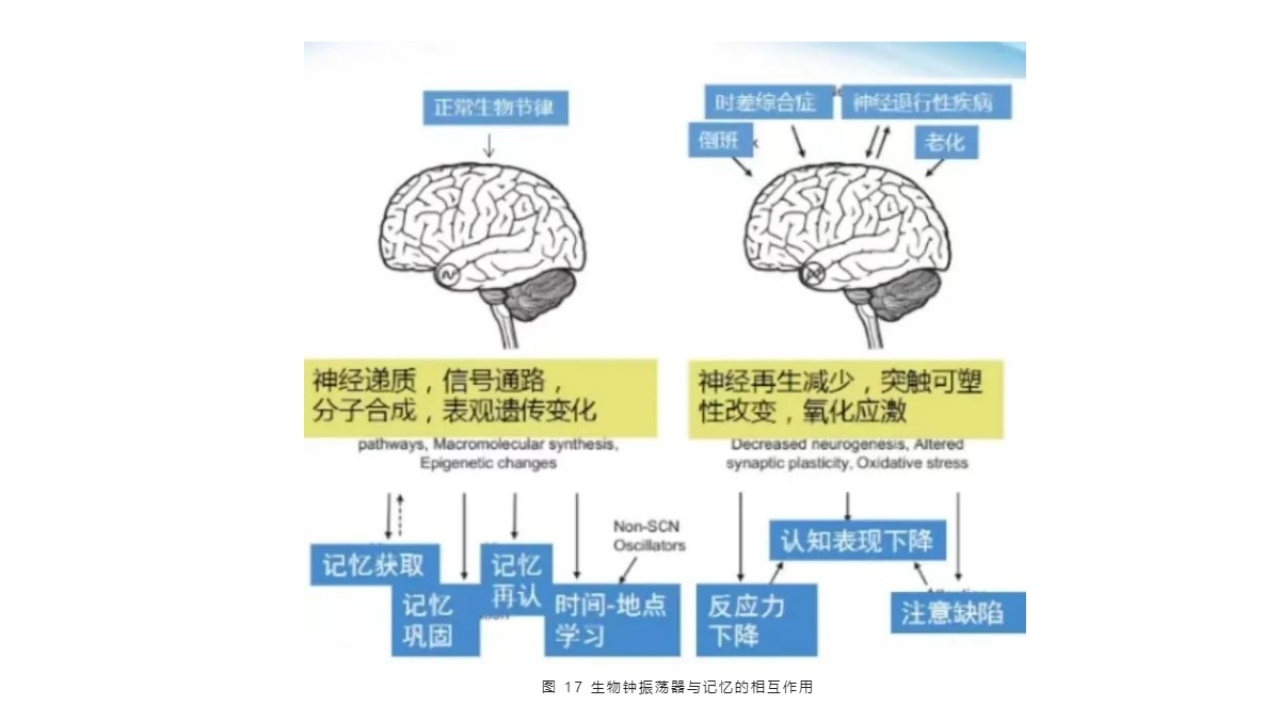
生物钟通过多种分子机制调控学习和记忆,环境和行为因素导致生物钟的去同步化,进而引起认知功能障碍。
一项针对睡眠障碍患者与痴呆发生风险的荟萃分析,纳入18个纵向研究包含246,786例患者,结果显示与无睡眠障碍患者相比,睡眠障碍患者(包括失眠、睡眠呼吸障碍、白天嗜睡、睡眠相关运动障碍、昼夜节律紊乱及非特异性睡眠问题),痴呆风险增高1.19倍(RR等于1.19,95%CI:1.1-1.29,p等于0.0001)。
一项以台湾人群为基础研究的病例对照研究中,在2002-2004年间纳入失眠患者51745例,无失眠患者258715例,采用cox比例风险模型来评估原发性失眠患者在校正社会人口特征和并发症后痴呆的发生风险,结果显示在校正后原发性失眠患者痴呆发生风险为无失眠患者的2.14倍(95%Cl:2.01-2.29)。
一项荟萃分析,总结了定量的老年人睡眠时间长短对认知功能损伤的影响,结果显示睡眠时间过长或者过短均可加重认知功能损伤。一项纵向研究为期9年,针对睡眠结构改变与痴呆和阿尔茨海默病的发生关系进行了总结,结果显示中/重度睡眠减少会增加痴呆发生风险。
美国一项纵向研究,研究结果显示睡眠紊乱增加老年女性MCI和痴呆的发生风险。
一项研究回顾性分析了60例具有轻度认知障碍的门诊患者,其中35例在睡眠时接受了日常3-9mg,为期9-24个月的褪黑素治疗,褪黑素治疗后Rey词语学习能力增加,睡眠质量、清醒时间增加,抑郁情绪增加。
(3)OSA与认知功能障碍机制
OSAS导致认知功能障碍机制为:
a.认知功能与睡眠分期相关的原因。浅睡眠增多,深睡眠减少,导致大脑不能充分休息、睡眠质量及组织的合成代谢下降,引发日间嗜睡,注意、集中及警觉性的下降;REM期减少,导致脑内蛋白合成及新突触建立,引发学习和记忆下降。
b.低氧程度与认知受损程度相关。低氧的程度及间歇性低氧/再氧合过程的频率会影响神经细胞凋亡的程度,认知功能受损的程度。一项纳入95例患者的研究中发现,OSAH可以加重缺血性脑血管病患者的认知障碍。
脑卒中伴OSAS与认知功能的相关性,约50%的脑卒中患者出现认知障碍,OSA加重脑卒中患者的认知损伤。Caffarra等发现,OSAS患者单光子发射计算机断层成像术(SPECT)上存在脑血流量的下降,且主要在海马、海马旁回、舌回、楔回、额顶颞皮质等区域,这些部位的脑血流下降导致记忆、执行功能和语言能力的受损。OSAS患者白天嗜睡,意识清晰度减低,注意力往往难以集中,短期记忆受损明显。
(4)生物钟与神经退行性改变
生物钟和退行性改变是非常重要的。昼夜节律生物钟的改变可以引起代谢、抗氧化,以及褪黑素和DNA修复中的损害,最后引起氧化应激,以及在DNA的氧化,修复过程中,最后导致脑细胞坏死与神经凋亡,以及细胞所谓间隙的生物聚集,毒素聚集。所以,昼夜节律障碍与帕金森,包括α-突触核蛋白病有非常大的关系。
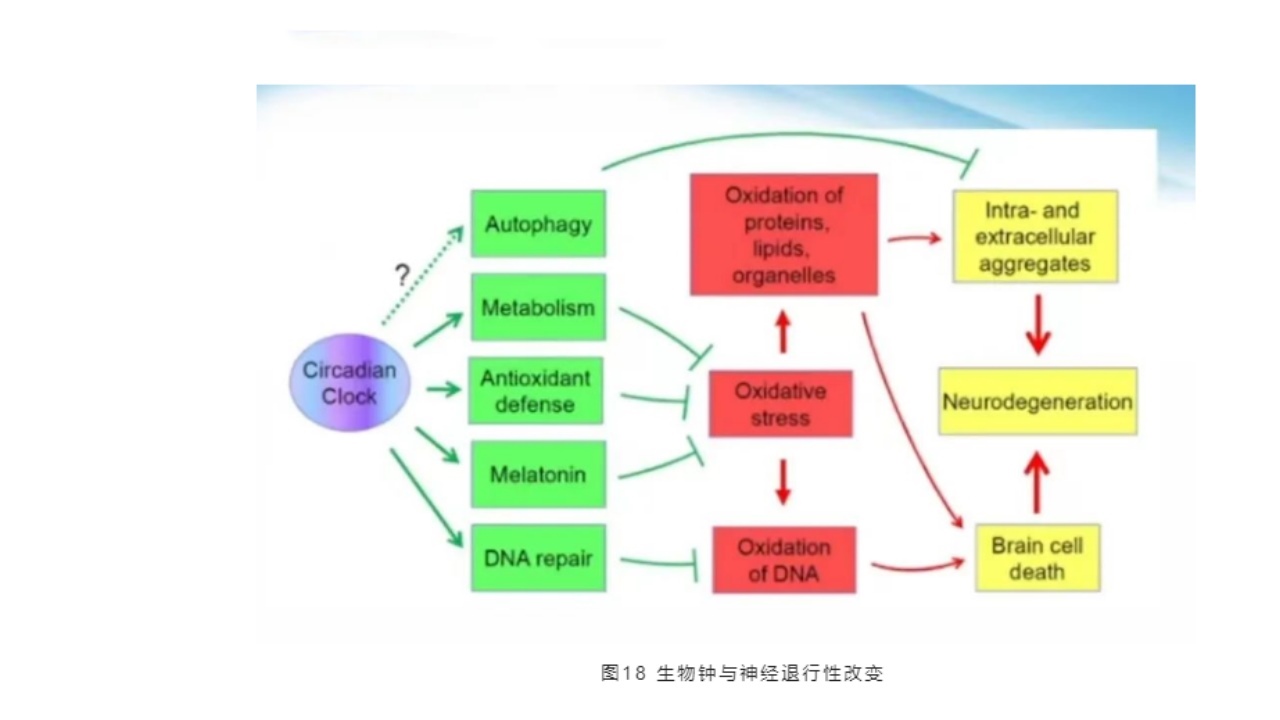
生物钟节律的破坏会大大促进神经炎症的发生,α-突触核蛋白在SCN中开始积累,SCN内部的生物节律被破坏,线粒体的呼吸功能在24h中呈现一定节律,且受生物钟蛋白调控,线粒体异常在PD中起作用,褪黑素等其他中心和外周时钟的调节受损,对行为和生理功能产生负面影响。
另外,昼夜节律的改变,引起帕金森病的因素也是非常重要的。所以,利用褪黑素可以抑制外源性的左旋多巴的氧化损伤,也可以改善夜间的睡眠障碍,即可以改善昼夜节律,保护多巴胺能神经元,褪黑素治疗有助于改善帕金森病患者的主观睡眠质量。
其实,α-突触核蛋白病最常见的睡眠障碍是在原发性的夜间REM期的睡眠行为障碍,一旦发现患者夜间睡眠中有喊叫、行为异常,甚至有外伤,诊断为iRBD后,向α-突触核蛋白病高风险的转化需要引起特别的重视。
近年来,鉴于iRBD向突触核蛋白病的高转化风险,研究者提出“isolatedRBD”,临床上也更加重视。iRBD向突触核蛋白病发展中,不同的时期引起不同的症状,α-突触核蛋白病程发展从背侧IX/X运动核、中间网状区、嗅球到中缝核尾端、延髓巨细胞网状结构(MCRF)、蓝斑核及周围结构(SLD)、背外侧核下部(SLD),再到脑桥核(PPN)、黑质(SN)、基底节核团(NBM),核团的退变出现帕金森症状,到边缘叶核皮层退变。MSA可能较PD更早的出现RBD症状,RBD症状随着MSA病程进展而减轻甚至消失,PD目前尚无随着病程进展RBD症状减轻或消失的文献报道。
帕金森病伴RBD与帕金森病不伴RBD相比,从病程长短、Hoehn-Yahr分期、合并精神症状、使用左旋多巴剂量、REM期睡眠及睡眠周期腿动、卧立位血压、认知损害均明显加强。
在帕金森伴RBD的5~20年的病程发展中,睡眠障碍、抑郁、立体视觉障碍、嗅觉障碍、便秘是前驱症状,在10~15年出现运动症状。在帕金森病的临床中要关注患者睡眠障碍,尤其是RBD的诊断和治疗。
(5)睡眠障碍与头痛——发生机制
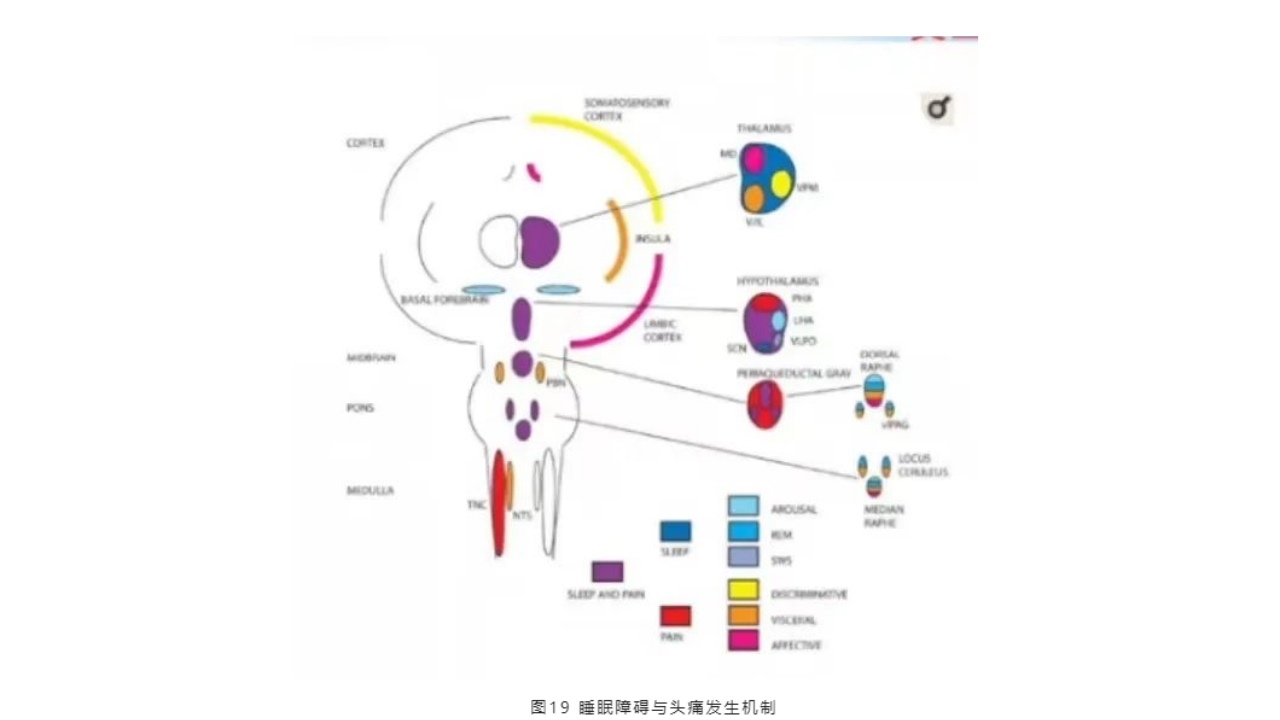
图中显示涉及损伤感受和睡眠调节的皮质、皮质下和脑干结构,其中共有的结构突触包括:腹外侧导水管周围灰质(vIPAG)、后下丘脑、外侧下丘脑(PHA、LHA)。

挪威流行病学调查研究显示,失眠或偏头痛、紧张型头痛的发生具有显著相关性;失眠患者发生偏头痛和紧张型头痛的风险比(OR值)较睡眠正常组人群显著增加。
夜间偏头痛发作是睡眠中断的典型后果,偏头痛可能与原发性睡眠障碍有关(尤其是失眠),睡眠障碍与偏头痛之间可能存在基因联系和共同神经生物学基质。睡眠障碍与紧张性头痛(TTH)相互影响,且睡眠障碍能触发TTH并促进其复杂化或加剧,失眠是新发TTH的独立危险因素,而研究表明,调整好睡眠,是对失眠问题早期发现和干预,作为一级或二级预防TTH的有效措施。
三、总结
睡眠障碍有望成为神经系统疾病的干预靶点,睡眠的干预可能会延缓神经系统疾病的发生、发展。
1.睡眠障碍会增加卒中发病风险,影响卒中的预后;
2.睡眠障碍通过多种途径增加认知损伤的风险,在AD的发生发展中起重要作用;
3.睡眠障碍增加癫痫发作频率,不利于癫痫的控制;
4.RBD与α-突触核蛋白病关系密切,代表症状较重的疾病亚型;
5.睡眠障碍与紧张性头痛相互影响,睡眠障碍能触发紧张性头痛并促进其复杂化或加剧;
6.睡眠障碍的干预有助于延缓神经系统疾病的发展,改善预后。
[声明:本网站所有内容,凡未注明来源为“转载”,版权均归巢内网所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:巢内网”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们]

